Химия для 8 класса — Усманова М.

| Аты: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Баспагер: | Атамура |
| Жылы: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Кітап тілі: | Орыс |
Страница - 29
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
А
Аллотропия — явление существования химического элемента в виде нескольких простых веществ. Аллотропия зависит от числа атомов в молекуле или от структуры кристалла.
Амфотерность - это способность вещества реагировать с кислотами и щелочами.
Атмосфера земли - по массе: 75,6% - N2, 23,1% - О2, 1% - благородные газы и газы переменного состава; по объему: 78,09%- N2, 20,95% - О2, 0,03% - СО2, остальное - благородные газы.
Атом - мельчайшая химически неделимая частица молекулы.
Атомная единица массы (а. е. м.) - 1/12 массы атома углерода.
В
Валентность - способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Валентность - величина, определяемая числом неспаренных электронов, участвующих в образовании химических связей.
Вещества - составляющие тел.
Возбужденное состояние атома - в результате внешнего воздействия (нагревание, облучение) электроны переходят на орбитали с более высокой энергией.
Возгонка (сублимация) - переход вещества из твердого состояния в газообразное, минуя жидкую стадию.
Г
Галогены - элементы главной подгруппы VII группы (F, Сl, Вr, I).
Гетерогенные смеси - состоят из веществ в разных агрегатных состояниях.
Гомогенные смеси - состоят из веществ в одинаковых агрегатных состояниях.
Горение - процесс окисления, идущий с выделением тепла и света с самоускорением.
Гремучий газ - смесь двух объемов водорода и одного объема кислорода.
Группа - вертикальный ряд элементов с одинаковой валентностью в соединениях с кислородом. Группы подразделяются на основные и побочные.
3
Закон постоянства состава - состав чистого вещества молекулярного строения независимо от способа получения постоянен.
Закон сохранения массы веществ - масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Заряд ядра атома определяется порядковым номером элемента в ПС, т. е. числом протонов.
И
Изотопы - вид атомов с одинаковым зарядом ядра, но с разной массой (т. е. содержат одно и то же число протонов, но разное число нейтронов).
Индексы - величины, показывающие число атомов в молекуле.
Индикатор (определитель) - химическое вещество, изменяющее окраску при изменении концентрации одного компонента в растворе.
Ионная связь - связь между ионами, образующаяся за счет электростатического притяжения.
Ионы - заряженные частицы, образующиеся в результате отдачи или присоединения элементом электронов.
К
Катализатор - вещество, которое изменяет скорость реакции, но не расходуется в результате реакции.
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металлов и кислотного остатка.
Ковалентная связь - связь, осуществляемая путем образования общей электронной пары за счет спаривания неспаренных электронов между атомами.
Концентрация растворов - количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя. Растворы с большой концентрацией растворенного вещества называются концентрированными, с малой - разбавленными.
Кристаллическая решетка - расположение кристаллов в пространстве в определенном порядке. Кристаллические решетки подразделяются на атомные, ионные, молекулярные и металлические в зависимости от типа частиц, расположенных в узлах кристаллической решетки.
Круговорот кислорода в природе - фотосинтез и процессы, в которых расходуется кислород.
М
Массовая доля - отношение массы растворенного вещества к массе раствора.
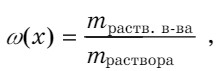
Молярная концентрация — количество растворенного вещества в литре раствора:
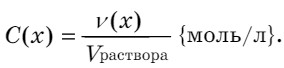
Молярная масса - масса 1 моля вещества (г/моль).
Молярный объем (Vm) - объем 1 моль газа при нормальных условиях (Vm = 22, 4 л/моль).
Н
Насыщенный раствор - устойчивая система, в которой количества веществ, переходящих в раствор и осаждающихся из раствора в единицу времени, равны.
Нейтрон - элементарная частица, входящая в состав ядра атома, массой 1 а. е. м., не имеет заряда.
Ненасыщенный раствор - раствор, в котором концентрация растворенного вещества меньше, чем для насыщения.
Неполярная ковалентная связь - связь, образующаяся между атомами с одинаковой электроотрицательностью.
Неспаренный электрон - одиночный электрон в ячейке.
Нормальные условия - t° = О°С, р = 1 атм.
Нуклоны - общее название протонов и нейтронов.
О
Озон (О3) - аллотропное видоизменение кислорода под действием ультрафиолетового облучения.
Оксиды - сложные вещества, состоящие из атомов двух элементов, одним из которых является кислород.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
Относительная атомная масса элемента - число, которое показывает, во сколько раз абсолютная масса данного атома больше 1/12 массы атома углерода, т. е. а. е. м.
Относительная молекулярная масса вещества показывает, во сколько раз масса данной молекулы больше атомной единицы массы.
Относительная плотность - отношение масс газов, взятых при одинаковых условиях и с одинаковым объемом:
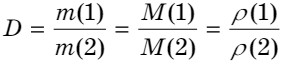
Перенасыщенный раствор - раствор, в котором концентрация растворенного вещества больше, чем для насыщения.
ПДК (предельно допустимая концентрация) — концентрация вещества, не оказывающая вредного воздействия на окружающую среду.
Период — горизонтальный ряд элементов в Периодической системе, начинающийся со щелочного металла и заканчивающийся инертным газом.
1—3-й периоды - малые.
4-7-й периоды - большие.
Плотность (p) - отношение массы вещества к его объему:
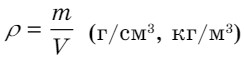
Плотность раствора - масса единицы объема раствора, измеряется ареометром (г/мл, г/см3, кг/м3).
Полярная ковалентная связь - связь, образующаяся между атомами с различной электроотрицательностью.
Порядковый номер элемента - определяет заряд ядра атома и общее число электронов в атоме.
Простые вещества состоят из атомов одного элемента.
Протон - элементарная частица, входящая в состав ядра атома, масса 1 а. е. м., заряд +1.
Р
Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц.
Раствор - гомогенная система переменного состава, состоящая из двух и более компонентов.
Растворимость (коэффициент растворимости) - масса вещества, необходимая для образования насыщенного раствора в 100 г растворителя при данной температуре.
Реакции замещения - реакции, при которых атомы или молекулы простых веществ замещают атомы или молекулы в составе сложных веществ.
Реакции обмена протекают между сложными веществами, в результате образуются два новых сложных вещества.
Реакции окисления с участием кислорода - коррозия, гниение и брожение, т. е. медленное окисление.
Реакции разложения - реакции, при которых молекулы сложных веществ распадаются на несколько простых веществ.
Реакции присоединения - реакции, в результате которых из нескольких простых или сложных веществ получают одно сложное вещество.
Ряд активности металлов - ряд металлов, расположенных по уменьшению их активности.
Реакция нейтрализации - взаимодействие кислот и оснований с образованием соли и воды.
C
Свойства — признаки, по которым вещества отличаются друг от друга.
Смесь - система, состоящая из нескольких распределенных друг в друге веществ, каждое из которых сохраняет свои физические и химические свойства.
Сложные вещества состоят из атомов различных элементов
Соли - сложные вещества, состоящие из атомов металлов и кислотного остатка.
Соли основные - соли, в молекулах которых кроме кислотных остатков содержатся также гидроксогруппы.
Соли кислые - соли, в молекулах которых кроме атомов металлов содержатся также атомы водорода.
Спаренные электроны - пара электронов в ячейке.
Спин - направление вращения электрона вокруг своей оси.
Стандартные условия - t° = 25°С, р = 101,3 кПа.
Стехиометрический коэффициент - величина, показывающая число молей вещества; в химических уравнениях стоит перед формулами простых и сложных веществ.
Т
Тела - окружающие нас предметы, которые имеют объем и форму.
Термохимическое уравнение - уравнение химической реакции, в котором указаны тепловой эффект и агрегатное состояние исходных веществ и продуктов реакции.
Топливо - источник энергии (твердое, жидкое, газообразное).
У
Уравнение химической реакции - условная запись химической реакции с помощью химических формул и математических знаков.
Ф
Физические явления - изменения веществ, при которых меняются только форма и агрегатное состояние.
Физические свойства веществ - вид, запах, цвет, агрегатное состояние, растворимость, температуры плавления и кипения.
X
Химия - наука о веществах и закономерностях их превращений.
Химическая формула показывает качественный и количественный состав молекулы.
Химические реакции (химические явления) - превращения одних веществ в другие.
Химический элемент - определенный вид атомов, характеризуется определенным зарядом ядра.
Ч
Число Авогадро (NА) - величина, показывающая число структурных единиц (атом, молекула, ион) в одном моле любого вещества. NА = 6,02 • 1023 моль-1.
Чистые вещества - состоят из одинаковых молекул.
Щ
Щелочные металлы - элементы главной подгруппы I группы (Li, Nа, К, Rb, Сs).
Э
Экзотермические реакции идут с выделением энергии, а эндотермические реакции - с поглощением энергии.
Электроотрицательность - величина, характеризующая свойство атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами соединений.
Электрон - элементарная отрицательно заряженная частица. Число электронов в атоме равно числу протонов.
Я
Ядро атома - положительно заряженная частица, состоящая из протонов и нейтронов, находится в центре атома. Масса ядра атома определяется суммой масс протонов и нейтронов.
СПИСОК ЛИТЕРАТУРЫ
- Габриелян О.С. Химия, 8 класс. М., 2013. — 288 с.
- Ерёмин В.В., Дроздов АА, Кузьменко Н.Е., Лунин В.В. Химия, 8 класс. - Оникс.
- Кузнецова Л.М. Химия, 8 класс. Учебник. 6-е изд., стереотип. - М.: Мнемозина, 2011. — 224 с.
- Кузнецова Н.Е., Титова И.М., Гара Н.Н. Химия, 8 класс. Учебник. 4-е изд. — М.: Вентана-Граф, 2012. - 256 с.
- Оржековский ПА., Мещерякова Л.М., Шалашова М.М. Химия, 8 класс. Учебник. - АСТ Астрель, 2013. - 272 с.
- Рудзитис Г.Е., Фельдман Ф.Г. Неорганическая химия, 8 класс. 15-е изд. - М.: 2011. - 176 с.
- 1С: Образовательная коллекция. Химия для всех - ХХ1: Решение задач. Самоучитель.
- Химия для всех - ХХ1: Химические опыты со взрывами и без. Мультимедийное пособие. Сайт разработчика www.splint.org
- Электронные ресурсы:
http: //shool-collection.edu.ru.
http: //festival
http: //xumuk.ru.
http: //alxumuk.ru.
http: //www.allend.ru/edu/chem3.htm.
http: //chemistry.narod.ru.
http: //www.nob-inf.narod.ru.
http: //experiment.edu.ru.
