Химия для 8 класса — Усманова М.
Учебник подготовлен в соответствии с Типовой учебной программой по предмету «Химия» для 7-9 классов уровня основного среднего образования по обновленному содержанию, утвержденной Министерством образования и науки РК.
ПРЕДИСЛОВИЕ
Дорогие восьмиклассники!
В этом году вы продолжаете изучение химии — одного из самых интересных разделов естествознания.
Химия — наука о веществах и их превращениях. Постигая ее основы, шаг за шагом вы будете знакомиться с удивительным миром веществ, которые нас окружают и из которых мы с вами состоим.
Учебник познакомит вас с теоретической базой химии — атомно-молекулярным учением, вытекающими из него основными химическими понятиями (атом, молекула, моль, мольный объем и др.). Затем вы продолжите изучать строение вещества, Периодический закон — фундамент всей химии элементов. Хорошее усвоение этого материала необходимо для дальнейшего углубленного изучения химии в старших классах.
В учебнике прослеживается причинно-следственная связь между свойствами, строением и составом веществ. Показана ведущая роль химии как теоретической основы многих промышленных процессов в решении экологических проблем, в формировании культуры потребления товаров повседневного спроса.
Успешное изучение химии невозможно без знания современной химической символики. Поэтому авторы большое внимание уделяют освоению химического языка, а также решению расчетных задач (по формулам и уравнениям) и методам выполнения лабораторных и практических работ, творческих заданий.
После каждой темы даны задачи и упражнения трех уровней сложности, что обеспечивает разноуровневый подход в обучении.
Каждая тема завершается краткими выводами, которые вы обязательно должны запомнить. В дальнейшем эти выводы будут расширены и углублены.
Представленные в учебнике рисунки, схемы, таблицы, графики наглядно раскрывают суть изучаемого материала.
В системном порядке даны объекты исследования химии и способы их изучения. Знакомясь со способами получения и применения веществ, вы получите развернутое представление о ведущей роли химии в современном мире.
Под рубриками «Знаешь ли ты?», «Запомни!», «Это интересно!», «Играем, думаем, учимся!» помещены научно-познавательные материалы, адресованные любознательным ученикам.
Интересны, важны сведения о богатейших природных запасах и химической промышленности Казахстана.
В конце учебника даны основные понятия и термины, которые вы должны знать после изучения химии в 8 классе.
Желаем вам успехов в изучении одного из самых увлекательных, но и самых трудных школьных предметов!
Глава I. ДВИЖЕНИЕ ЭЛЕКТРОНОВ В АТОМАХ
§1 РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ В АТОМАХ
Вспомните! Атом, молекула. Строение атома.

Из курса 7 класса мы узнали, что атом является сложной системой, состоящей из ядра и электронов (рис. 1). Выясним теперь закономерности расположения электронов вокруг ядра. Число электронов равно заряду ядра атома (атомному номеру элемента). Однако электроны притягиваются к ядру не с одинаковой силой, так как обладают различным запасом энергии и поэтому находятся на разном расстоянии от ядра.
Электроны с близкими значениями энергии располагаются на одинаковом расстоянии от ядра. Эти расстояния называются энергетическими уровнями. Их обозначают буквой n и нумеруют по мере удаления от ядра: 1, 2, 3, 4, 5, 6, 7. Значение n определяется номером периода, в котором расположен элемент. Максимальное число электронов на каждом энергетическом уровне (емкость энергетического уровня) определяется формулой N(e) = 2n2, где N- число электронов, n - номер энергетического уровня. Если n = 1, N = 2; n = 4, N = 2 • 42 = 32 электрона.
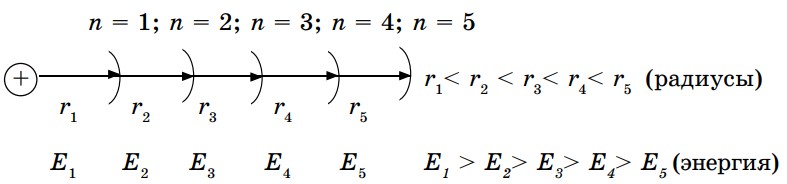
Электроны, расположенные ближе к ядру, сильнее притягиваются к нему. По мере отдаления от ядра энергия связи уменьшается. Радиус r показывает удаленность каждого энергетического уровня от ядра.
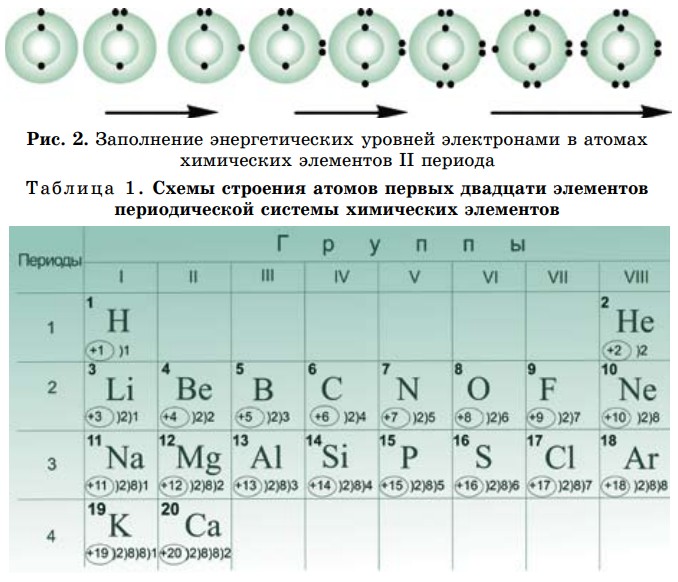
Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни (рис. 2). Почему так важно знать, как располагаются электроны в атоме? Потому что от строения электронных оболочек элемента зависят его физические и химические свойства (табл. 1). Потому что при непосредственном участии электронов атомов происходят образование и разрыв
химических связей, т. е. протекают химические реакции. Скорость движения электрона очень велика, и определить его положение в пространстве в определенный момент времени невозможно. В одном месте пространства его можно обнаружить часто, в другом — редко. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью (s, p, d, f).
Форма электронных облаков различная: сферическая обозначается буквой s (s-облако); гантелеобразная — р-облако, причем р-облака ориентированы взаимно перпендикулярно вдоль трех осей x, y, z (рис. 3).
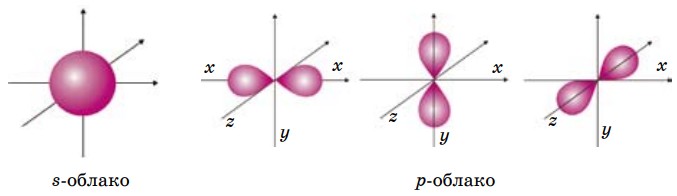
s-облако может располагаться в пространстве симметрично точке пересечения осей координат, поэтому его обозначают одной ячейкой 🠁. р-облако может располагаться вдоль трех осей x, y, z, поэтому их обозначают рх, ру, pz или тремя ячейками 🠁🠁🠁. На одном энергетическом уровне могут находиться электронные облака различной формы, которые образуют подуровни.
Электроны вращаются не только вокруг ядра, но и вокруг своей оси, как Земля вокруг Солнца и своей оси.
Вращение электрона вокруг своей оси называют спином (от англ. spin — волчок). Электроны могут вращатся по часовой стрелке или против нее. На каждой орбитали могут располагаться только два разнонаправленных электрона. Поэтому при составлении электронно-графических формул атомов электроны изображают в ячейке двумя разнонаправленными стрелками ↑↓.
Электронное облако, энергетический уровень, электронная формула, ячейка, спин.
A
- Как заряжены электроны, ядро?
- Как определяются заряд ядра атома и число электронов, вращающихся вокруг ядра?
- Дайте определение следующих понятий: электронное облако, энергетический уровень, ячейка, спин.
В
- Назовите формулу, определяющую электронную емкость энергетического уровня.
- Сколько электронов вращаются на s-, р-орбиталях.
С
- Как вы считаете, с какого энергетического уровня легче отрывается электрон: с внутреннего или внешнего?
- Рассчитайте электронную емкость третьего энергетического уровня.
§2 ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ
Теперь перейдем к рассмотрению электронных формул атомов. Начнем с первого элемента в таблице Менделеева — атома водорода. У атома водорода имеется один электрон, который расположен на s-подуровне первого энергетического уровня, поэтому электронная формула атома водорода 1s1, атома гелия — 1s2 («один-эс-два»).
В Периодической системе атомы водорода и гелия расположены в 1-м периоде, т. е. у этих элементов запас энергии электронов одинаковый, поэтому они находятся на одном энергетическом уровне. Согласно формуле N = 2 п2, на первом энергетическом уровне могут находиться только 2 e.
Следующий: литий — элемент 2-го периода. У лития имеются два энергетических уровня вокруг ядра, внутренний повторяет электронное строение атома гелия. Два его электрона находятся на первом энергетическом уровне, третий электрон — на втором. Во 2-м периоде п = 2, N = 2 п2, т. е. N = 2 • 22 = 8. Итак, на втором энергетическом уровне могут вращаться восемь электронов (табл. 2).
Таблица 2. Заполнение энергетических уровней электронами элементов второго периода


У атома неона второй энергетический уровень заполнен электронами, т. е. второй слой завершен.
Такая закономерность повторяется на третьем энергетическом уровне — от натрия до аргона. У элементов этого периода строение внутренних двух уровней повторяет структуру неона (табл. 2).
У атома аргона завершается третий энергетический уровень. Элементы, у которых внешний энергетический уровень завершен, обладают инертностью.
После аргона в таблице расположен калий. У атома калия следующий электрон образует новый, четвертый энергетический уровень, а внутренние три уровня повторяют электронное строение аргона (табл. 1).
При сравнении электронной структуры элементов 2-го и 3-го периодов заметно, что число электронов на внешнем энергетическом уровне у атомов лития, натрия и калия одинаковое (1 e ). Такая же закономерность наблюдается у атомов бериллия, магния и кальция (2 e ).
Такие сходства в структурах внешних уровней наблюдаются у элементов, расположенных в одной группе, например, у фтора и хлора 7 электронов. У неона и аргона на внешних энергетических уровнях по 8 электронов.
Каждый период (кроме 1-го) начинается с щелочного металла и заканчивается инертным газом. По периодам слева направо число электронов увеличивается от 1 до 8, электроны внешнего энергетического уровня слабее притягиваются к ядру. У элементов главных (А) подгрупп электроны внешнего энергетического уровня являются валентными, т. е. определяют валентность элемента (табл. 3).
Рассмотренные 20 элементов являются элементами главных подгрупп, их очередные электроны помещаются на внешних s - и р-подуровнях, поэтому их называют s - и р-элементами.
К s-элементам относятся элементы главных подгрупп I и II группы; к р-элементам — элементы главных подгрупп III—VIII группы. Объединение элементов в одну группу объясняется одинаковым числом у них валентных электронов.
Ознакомившись с электронным строением атома, мы можем дать следующее определение периодов и групп в Периодической системе:
Таблица 3. Схемы строения внешних электронных слоев атомов первых двадцати химических элементов

Периодами называются горизонтальные ряды элементов с одинаковым числом энергетических уровней, начинающиеся со щелочного металла и заканчивающиеся инертным газом (кроме 1-го периода).
Группами называются вертикальные ряды элементов с одинаковым числом валентных электронов.
A
- Напишите электронные формулы кальция, фосфора, серы, азота.
- Определите заряды ядер следующих атомов: хлора, бериллия, алюминия. Ответьте на следующие вопросы по этим элементам:
а) сколько электронов вращаются вокруг ядра?
б) сколько энергетических уровней?
в) сколько электронов на внешнем энергетическом уровне?
В - Напишите электронно-графические формулы бора, кремния, кислорода, фтора.
- Рассчитайте, сколько электронов может находиться на втором энергетическом уровне.
- Напишите валентные электронные формулы F, Mg, B.
C
- Определите элемент, соответствующий валентным электронам 3s 23p3.
- Напишите электронную формулу элементов III периода.
- Напишите электронную формулу элемента, атомный номер которого равен 16. Определите число протонов и нейтронов в ядре и число электронов, вращающихся на внешнем энергетическом уровне.
Лабораторный опыт №1
Изготовление моделей атомов
Цель работы: изготовить модели атомов.
Оборудование: разноцветный пластилин, шаростержневые модели атомов.
Ход работы
Атомы элементов можно смоделировать с помощью разноцветного пластилина (рис. 4, 5).
Смоделируйте атомы: водорода, углерода, серы, иода, кислорода, железа. Подберите цвета пластилина или готовых шариков таким образом, чтобы цвета соответствовали простым веществам: водород — бесцветный (можно белый); углерод — черный; сера — желтая; йод — темно-красный; кислород — бесцветный (можно голубой или синий, т.к. сжиженный кислород голубого цвета); железо — серый.


