Химия для 8 класса — Усманова М.

| Аты: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Баспагер: | Атамура |
| Жылы: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Кітап тілі: | Орыс |
Страница - 11
Глава VI. ЗНАКОМСТВО С ЭНЕРГИЕЙ В ХИМИЧЕСКИХ РЕАКЦИЯХ
§20. ГОРЕНИЕ ТОПЛИВА И ВЫДЕЛЕНИЕ ЭНЕРГИИ
Вспомните: топливо, горение, окисление, медленное окисление, пожары. В каких регионах Казахстана добывают газ, каменный уголь и нефть?
Топливо — горючие вещества, основным компонентом которых является углерод. Топливо используется для получения при его сжигании тепловой энергии, а также в качестве сырья в химической промышленности.
По агрегатному состоянию топливо делится на твердое, жидкое и газообразное; по происхождению - на природное и искусственное.
Природные виды топлива используются в том виде, в каком они добываются. К ним относятся каменные и бурые угли, природные газы, древесина, горючие сланцы, торф. К другой подгруппе топлива (искусственные) относятся продукты переработки природных топлив (бензин, керосин, лигроин, мазут).
Все виды топлива состоят из одних и тех же элементов. Разница в них заключается в процентном содержании этих элементов. Топливо состоит из двух групп элементов. В первую группу входят элементы, которые горят или же поддерживают горение, такие как: углерод, водород, сера, кислород. А во вторую входит элемент - азот, который и не горит и не поддерживает горение.
При сжигании любого вида топлива образуются оксиды. Например, при сгорании угля и углеродсодержащего топлива образуется углекислый газ, оксид углерода (II) и другие вещества:
С + О2 = СО2 + Q СО2 + С = 2СО + Q, где Q — тепловая энергия.
Виды топлива отличаются друг от друга по количеству выделяемого тепла при полном сгорании. Основным качественным показателем любого топлива является теплотворная способность топлива.
Теплотворной способностью топлива называется количество тепла, которое выделяется при полном сгорании 1 м3 газообразного или 1 кг твердого топлива. Теплотворная способность каменного угля 7000 ккал/кг, мазута - 10 000 ккал/кг, природного газа - до 15 000 ккал/м3. При сжигании 1 кг угля выделяется в 3 раза, нефти в 4 раза, водорода в 10 раз больше тепла по сравнению с древесиной такой же массы. Чем выше теплотворная способность топлива, тем оно ценнее, так как для получения одного и того же количества тепла его потребуется меньше.
Все виды топлива можно рассматривать как продукт разложения (в отсутствие воздуха), и преобразования растительного и животного мира под воздействием высокого давления толстого слоя земли.
Твердое топливо. К естественным твердым видам топлива относятся: древесина, каменный уголь, антрацит, торф, сланец. К искусственным - кокс, пылевидный уголь, древесный уголь.
При обработке каменного угля в специальных печах без доступа воздуха при температуре 1000 — 1100°С получают кокс. Кокс является топливом в металлургических доменных печах. Древесный уголь получают в специальных печах. Он является лучшим топливом для кузнечных горнов. В нем не содержится золы и практически отсутствует сера.
Жидкое топливо. К естественным жидким видам топлива относят нефть. Но сырую нефть, как топливо в печах не применяют. А применяют продукты переработки:
- легкий бензин, авиационное топливо.
- тяжелый бензин (топливо для автотранспорта).
керосин (дизельное, котельное топливо и для реактивных самолетов). мазут - остаток перегонки нефти, применяют как котельное топливо.
Газовое топливо - выделяется из земли через естественные выходы буровых скважин. В настоящее время они находят широкое применение в промышленности и в быту.
А искусственное газовое топливо получают путем газификации твердых видов топлива в газогенераторах или как побочный продукт при коксовании угля. Теплотворная способность генераторного газа зависит от вида твердого топлива, из которого получен газ, и от способа газификации. Например, у торфяного генераторного газа теплотворная способность от 1500 до 1600 ккал/м3, а у каменноугольного генераторного газа — от 1200 до 1400 ккал/м3.
Водород - топливо будущего, он имеет массу преимуществ по сравнению с другими видами топлива.
Водород сгорает намного эффективнее, не имеет вредных выбросов. Самое главное - при сгорании водорода образуется природное вещество - вода. Природа не получит никакого вреда, т. е. он кроме эффективности еще и экологичен!
Водород - легко возобновляемое топливо, т. к. его можно получить из воды.
Он может быть использован во всех без исключения отраслях современного производства и транспорта.
Тогда почему же он не получил широкого внедрения и применения? Этому есть серьезные причины:
- технология получения (электролиз);
- способность хранения (занимают большой объем);
- взрывоопасен (дает «гремучую смесь» с кислородом).
Глобальное потепление — это постепенный подъем температуры на Земле.
Глобальное потепление является результатом скопления в атмосфере избыточного количества углекислого газа. Этот газ удерживает солнечное тепло и повышает температуру на Земле.
Земная атмосфера состоит из газов, которые удерживают тепловую энергию, приходящую от Солнца. Без этих газов солнечное тепло попросту уходило бы в Космос и на Земле было бы гораздо холоднее. Эти газы еще называют парниковыми, поскольку они удерживают тепло в атмосфере во многом так же, как тепло накапливается в парнике (парниковый эффект).
Однако равновесие этих газов было нарушено человеческой деятельностью, например, сжиганием горючих ископаемых (каменного угля и нефти), и сейчас в атмосфере гораздо больше углекислого газа. Он удерживает больше тепла, чем требуется Земле.
Ученые предсказывают, что к 2100 году средняя температура земной поверхности повысится на 1-5 градусов по Цельсию. Это глобальное потепление станет следствием парникового эффекта - образования газового слоя, задерживающего солнечную энергию в атмосфере Земли. Повышение температуры, в свою очередь, может повлечь за собой повышение уровня Мирового океана и помимо наводнений привести к очень резким переменам погоды на нашей планете.
Природные горючие богатства отличаются исчерпаемостью и не восстанавливаются. К тому же применение топлива в таких больших масштабах приводит к парниковому эффекту, потеплению и изменению климата. Поэтому человечество обеспокоено состоянием в этой области и собирается переходить на возобновляемые виды энергии солнца, ветра, воды. Глобальному вопросу современности была посвящена Всемирная выставка в Астане (ЭКСПО-2017), которая прошла с 10 июня по 10 сентября 2017 года. На ней все страны-участницы продемонстрировали свои инновационные технологии и достижения в этой сфере.
А
1. Дайте определение топливу. В каких агрегатных состояниях оно встречается?
2. Что такое теплотворная способность топлива? В каких пределах меняются эначения теплотворности топлива в зависимости от его вида?
В
- Перечислите вещества, относящиеся к твердым, жидким и газообразным видам топлива. Как они распределены по регионам нашей страны?
- Чем различаются разные виды топлива?
С
- Теплотворность газообразного топлива 10 000 ккал/м3. Какое количество тепла выделится при сгорании 500 л этого газа, если 1 ккал = 4,18 кДж.
Ответ: 20 900 кДж.
2. Пользуясь материалами Интернета и других источников, подготовьте сообщение об авариях на АЭС (Чернобыль, Фукусима).
§21. ЭКЗОТЕРМИЧЕСКИЕ И ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИ, ТЕРМОХИМИЧЕСКИЕ УРАВНЕНИЯ
Вспомните о реакциях, где выделяется тепло.
Все химические реакции протекают в различных условиях. Некоторые реакции идут с выделением теплоты, самопроизвольно (например горение бензина, керосина, газа), а некоторые требуют постоянного притока тепла (например, приготовление пищи).
Реакции, идущие с выделением тепла, называются экзотермическими, а с поглощением тепла — эндотермическими (от греческого экзо - внешний, эндо - внутренний).
Количество тепла, выделяющегося или поглощающегося при химической реакции, называется тепловым эффектом. Единицей его измерения является джоуль (Дж) или килоджоуль (кДж). Уравнения химических реакций, в которых указаны значения тепловых эффектов (О), называются термохимическими. Тепловые эффекты реакций зависят от агрегатного состояния веществ, которое в термохимических уравнениях указывается в скобках.
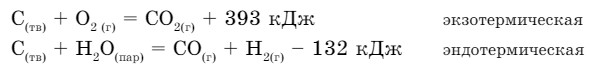
Зная значения тепловых эффектов реакций, можно управлять ходом этих реакций.
Рассмотрим величины теплоты образования 1 моля воды в жидком и газообразном состояниях:
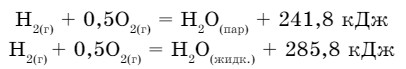
Теплота образования - это тепло, которое выделяется или поглощается при образовании 1 моля сложного вещества из простых веществ:
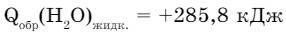
Из этого примера видно, что величина теплоты образования воды в разных агрегатных состояниях различна. Эти значения даны при стандартных условиях (t = 25°С, р = 101,3 кПа).
Каждое вещество располагает определенным запасом энергии, которая называется химической энергией. В химических реакциях она может превращаться в другие виды энергии (тепловую, световую, электрическую и т. д.) всегда в соответствии с законом сохранения и превращения энергии.
Изменение энергии с точки зрения кинетической теории частиц. Химические реакции протекают с выделением или поглощением тепла. А теплота является мерой хаотического движения частиц. Кинетическая теория исследует процессы, происходящие в веществе за счет движений частиц. Эта идея была предложена еще 460-360 лет до н. э. древнегреческим философом Демокритом.
Все вещества до реакции обладают определенным запасом внутренней энергии. А эта энергия слагается из кинетической и потенциальной энергии частиц. Кинетическая энергия обусловлена энергией поступательного, вращательного движения молекул, а потенциальная энергия — силами притяжения и отталкивания частиц.
Химическая реакция происходит за счет разрыва одних связей и образования новых. Происходит перегруппировка частиц, составляющих исходные вещества, что сопровождается выделением или поглощением энергии в виде тепла.
Экзотермическая, эндотермическая реакции, тепловой эффект, теплота образования.
А
1. Чтобы погасить зажженную спичку, мы дуем на нее. Аналогично раздувают угли, чтобы зажечь костер. Объясните почему.
2. Какие этапы процесса горения описывают словами: возгорание, горение, раздувание, тление? Расположите следующие слова в нужной последовательности (по ходу горения): искра, пламя, дым, пепел, уголь.
В
- Классифицируйте реакции по тепловым эффектам. Определите суммы количеств веществ (в моль) участвующих в реакциях разложения:
- 3CaO + P2O5 = Ca3(PO4)2 + Q
- 2NH3 = N2 + 3H2 — Q
- 2NO + O2 =2NO2 + Q
- Cu(OH)2 = CuO + H2O — Q
- CaO + H2O = Ca(OH)2 + Q
- Какие экзотермические и эндотермические реакции вам известны из повседневной жизни?
С
- Уравняйте схемы реакции, определите реакции, где тепловые эффекты являются для веществ теплотой образования.
- NO + O2 → NO2 + Q
- S + H2 → H2S + Q
- N2 + H2 → NH3 + Q
- N2 + O2 → NO - Q
- C + O2 → CO2 + Q
- Могут ли тепловые эффекты быть теплотой образования продуктов реакции? Дайте обоснованный ответ.
CaO + CO2 = CaCO3 + Q
2Na + Cl2 = 2NaCl + Q
C + 2N2 = CH4 + Q
Лабораторный опыт №4
Химические реакции, сопровождающиеся изменением энергии
Цель: исследовать химические процессы, которые идут с изменением энергии.
| Реактивы | Оборудование |
| Растворы: гидроксид натрия, соляная кислота, свежеприготовленный осадок Сu(ОН)2 | Стаканы, пробирки, шпатель, термометр, спиртовка, цилиндры (25 мл) |
Обратите внимание: Будьте осторожны при работе с растворами кислот и щелочей.
Опыт А. Экзотермические реакции.
Ход работы:
- Отмерьте в цилиндре по 25 мл растворов гидроксида натрия и соляной кислоты.
- Измерьте их температуру.
- Быстро налейте их в химический стакан и отметьте максимальную температуру.
Опыт Б. Эндотермические реакции.
Свежеприготовленный осадок Сu(ОН)2 осторожно нагревают на пламени спиртовки.
Вопросы и задания.
- Назовите тип реакций.
- Напишите уравнения реакций.
§22. РАСЧЕТЫ ПО ТЕРМОХИМИЧЕСКИМ УРАВНЕНИЯМ
А. Определение количества выделяемого или поглощаемого тепла по массе (количеству, объему) вещества.
Если при окислении 1 моль глюкозы в организме человека выделилось 2870 кДж тепла, какое количество тепла выделится при окислении 40 г глюкозы?

В. Определение массы вещества, вступившего в реакцию, по количеству выделившегося или поглощенного тепла.
1. Какая масса карбоната кальция разложилась и сколько образовалось оксида кальция и диоксида углерода, если в результате реакции поглотилось 1064,4 кДж тепла (CaCO3 = CaO + + CO2 - 177,4 кДж)?


С. Составление термохимического уравнения реакции по массе реагирующих веществ и по количеству поглощенного или выделившегося тепла.
Составьте термохимическое уравнение реакции, если в результате горения 16 г серы выделилось 148,5 кДж тепла.

B
- Рассчитайте теплоту образования Fе2О3, если при образовании 64 г Fе2О3 выделилось 328,88 кДж.
4Fе + 3O2 = 2Fе2О3
Ответ: Q = 822,2 кДж.
- Термохимическое уравнение взаимодействия аммиака с соляной кислотой: NH3(г) + НCl(г) = NH4Cl(тв) + 176,93 кДж. Рассчитайте количество аммиака, вступившего в реакцию, если выделилось 884,65 кДж тепла.
Ответ: 5 моль.
- При окислении 32 г Cu кислородом выделилось 81,05 кДж тепла. Рассчитайте тепловой эффект реакции (2Сu + O2 = 2СuО).
Ответ: 324,2 кДж.
С
- Сколько тепла выделится при образовании 30 л (н.у.) сернистого газа?
S + О2 = SО2 + 297 кДж.
Ответ: 397,77 кДж.
- Рассчитайте количество тепла, выделившегося при образовании 1 моля оксида фосфора (V), если при сгорании 9,3 г фосфора выделилось 223,8 кДж тепла.
Ответ: 1492 кДж.
- Рассчитайте количество тепла, выделяемого при сгорании 3,5 кг каменного угля. Уравнение реакции: С + О2 = СО2 + 393,5 кДж.
Ответ: 114 771 кДж.
Словарь по темам «Топливо», «Термохимические реакции»
| № п/п | Орыс | Қазақ | Английский |
| 1. | топливо | отын | fuel |
| 2. | виды топлива | отынның түрлері | types of fuel |
| 3. | теплотворность | отынның жылу бөлгіштігі | thermal conductivity |
| 4. | тепловой эффект | жылу эффектісі | heat effect |
| 5. | теплота образования | түзілу жылуы | heat of formation |
| 6. | экзотермические реакции | экзотермиялық реакция | exothermic reactions |
| 7. | эндотермические реакции | эндотермиялық реакция | endothermic reactions |
| 8. | термохимические уравнения | термохимиялық теңдеулер | thermochemical equations |
ДЕЛАЕМ ВЫВОДЫ
- Реакции, идущие с выделением тепла, называются экзотермическими, а с поглощением - эндотермическими.
- Термохимические уравнения - это химические уравнения, в которых указаны значения тепловых эффектов (Q).
Теплота образования - это тепло, которое выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ.
