Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 28
§55. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Водород, кислород, растворитель.
Под действием электрического тока или при температуре 2000°С происходит разложение воды. Эта реакция, как вы уже знаете, — один из способов получения водорода:
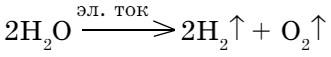
Разложение соединения на составные части называется анализом. Реакция получения сложных молекул (воды) из простых веществ называется синтезом:
2Н2 + О2 = 2Н2О
Взаимодействие воды с простыми веществами.
- Взаимодействие воды с активными металлами также рассматривалось нами как один из способов получения водорода в лабораторных условиях. При этом протекают реакции замещения:
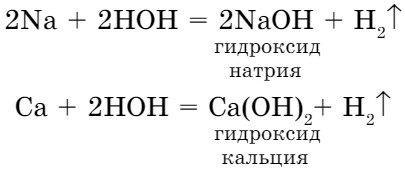
При взаимодействии металлов средней активности при нагревании с водой образуются оксид металла и водород:
При взаимодействии металлов средней активности при нагревании с водой образуются оксид металла и водород:
Мg + НОН → МgО + Н2↑
Малоактивные металлы с водой не реагируют.
- При определенных условиях вода реагирует с некоторыми неметаллами. При пропускании паров воды над раскаленным углем происходит реакция:
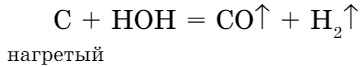
В результате реакции образуется смесь двух газов, которые способны гореть. Такая газовая смесь называется водяным газом.
При пропускании хлора через воду образуется смесь двух кислот хлора:
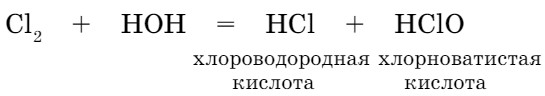
Взаимодействие воды со сложными веществами.
- C оксидами активных металлов вода реагирует с образованием растворимых оснований - щелочей:
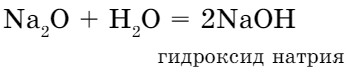

При взаимодействии оксида кальция (негашеная известь) с водой реакция протекает бурно с выделением большого количества тепла (рис. 78), и образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2 + Q
Отсюда можно сделать следующий вывод:
оксид активного металла + вода = = основание (щелочь)
- Гидриды активных металлов вступают во взаимодействие с водой по реакции:
МаН + Н2О = NаОН + Н2↑ СаН2 + 2Н2О = Са(ОН)2 + 2Н2↑ В результате реакции образуются щелочи и водород.
- Оксиды некоторых неметаллов взаимодействуют с водой с образованием кислот:
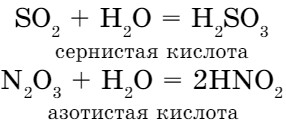
Следовательно:
оксид неметалла + вода = кислота
- Некоторые соли химически взаимодействуют с водой с образованием кристаллогидратов. Кристаллогидратами называют кристаллические гидраты определенного состава:
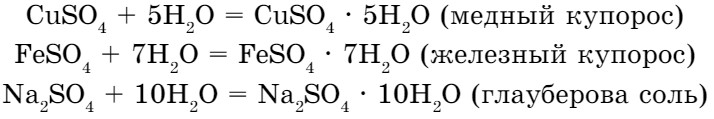
При расчете молекулярных масс кристаллогидратов масса воды суммируется с массой соли:
Mr(Na2CO3 • 10H2O) = 106 + 180 = 286.
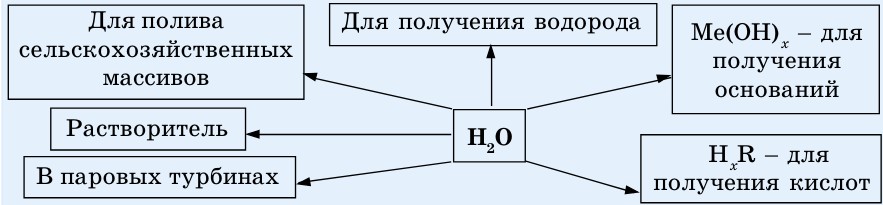
Применение воды. Вода — второй (после кислорода) по величине природный ресурс, используемый человеком. Применение ее в промышленности, сельском хозяйстве и в быту очень многообразно.
Основные области применения воды показаны на схеме 10.
Схема 10. Применение воды
Знаете ли вы!
- Содержание воды в костях достигает 31%.
- На вершине Эвереста вода кипит при 71°С.
- Жирафы могут обходиться без воды дольше, чем верблюды.

- Сколько литров водорода (н. у.) образуется, если в реакцию замещения с водой вступило 4,6 г натрия?
Ответ: 2,24 л.
- Определите процентную концентрацию соляной кислоты, если в 700 г воды растворили 112 г хлороводорода. Рассчитайте объемы (н. у.) газов, необходимых для получения 112 г хлороводорода.
Ответ: 13,79%, 34,37 л С12, 34,37 л Н2.
- Водный раствор хлорида бария содержит 32% этой соли, в расчете на безводную соль. Каково процентное содержание ВаСl2 • 2Н2О в данном растворе?
Ответ: 37,54%.
Знаете ли вы?
Сколько жидкости в нашем теле? 5 л крови; 2 л лимфы; 28 л внутриклеточной и межклеточной воды; 1,5 л слюны, 5 л желудочного сока; 1 л желчи; 0,7 л сока поджелудочной железы; 0,1-0,2 л воды в головном и спинном мозге. Конечно же, это не чистая вода, а растворенные в воде органические и неорганические вещества. Очень много воды в стекловидном теле глаза (99%), а меньше всего — в эмали зубов.
§56. ПРИЧИНЫ ЗАГРЯЗНЕНИЯ ВОДЫ. ЖЕСТКОСТЬ ВОДЫ И СПОСОБЫ ЕЕ УСТРАНЕНИЯ
Почему в жесткой воде мыло не пенится? Знаете ли вы причину этого явления?
В 1886 году немецкий ученый, дарвинист Эрнест Геккель ввел понятие «экология». В переводе с греческого это означает «наука о постоянном местожительстве». Химическая наука при решении вопросов охраны природы и рационального использования природных ресурсов имеет решающую роль. В то же время химическая промышленность, принося нам пользу, одновременно является источником загрязнения окружающей среды. Поэтому нельзя изучать химию, не касаясь экологической проблемы.
Причины загрязнения воды. Наиболее распространенным загрязнителем воды являются углеводороды (нефть и нефтепродукты), которые попадают в воду в основном при их транспортировке и авариях, а также радиоактивные вещества (рис. 79).
В промышленных районах загрязняются не только атмосфера, но и водные объекты. В Балкаше качество воды ухудшается из-за деятельности Балкашского медеплавильного завода, который сбрасывает в озеро использованную воду. На реке Ертис ПДК по железу, меди и марганцу превышены в 1,7-1,8 раза.

Только в Восточно-Казахстанской области в бассейн реки ежегодно сбрасывается 200 млн м3 сточных вод.
С точки зрения химического воздействия на природу, ученые выделяют следующие направления:
- потребление химических веществ из природы;
- загрязнение природы отходами человеческой деятельности;
- появление новых высокоактивных химических соединений, выделенных из природных источников или синтезированных человеком.
Многие экологические проблемы создает металлургическое производство. Его основные этапы:
- добыча руды на месторождениях;
- обогащение руды;
- переработка руды и получение металлов.
Для производства металлов необходимы более сложные технические приспособления, чем для переработки минералов. Поэтому производство металлов - очень дорогостоящая отрасль. Из каждой добытой 1000 т сырья 1/4 часть остается в земле. При первичной обработке и обогащении руды теряется еще 1/3 произведенного сырья. Ведь обычно обогащение производится по одному элементу, а все остальное не используется. Поэтому вокруг горнообогатительных комбинатов растут «горы» из остатков и отходов.
Некоторые их составляющие вымываются дождевой водой и выветриваются. Вследствие этого снижается плодородие прилегающих почв, загрязняются реки и озера. Тем самым создается опасное санитарно-гигиеническое состояние среды.
Для охраны природы разрабатываются различные мероприятия. Среди них:
- Комплексное использование руд с использованием циркуляционных принципов технологии.
- Разработка и использование экологически чистых источников энергии.
- Разработка новых фильтров, адсорбентов для задержания твердых и ядовитых газообразных отходов производства.
- Повышение степени очистки сточных вод с использованием современных технологий.
В нашей республике экологические проблемы волнуют жителей особенно в таких городах, как Усть-Каменогорск, Павлодар, Темиртау, Шымкент, Тараз, Балкаш, а также космодром Байконур и ближайшие районы.
Жесткость воды обусловлена наличием в ней ионов Са2+ и Мg2+. Чем выше в природной воде содержание этих ионов, тем больше ее жесткость.
В жесткой воде мыло не пенится, поэтому используют синтетические моющие средства. Из-за жесткости воды на внутренних стенках трубопроводов и паровых котлов оседает накипь - твердые соли (СаСО3, СаSО4). Жесткая вода имеет плохую теплопроводность, поэтому вызывает местный перегрев (рис. 80).
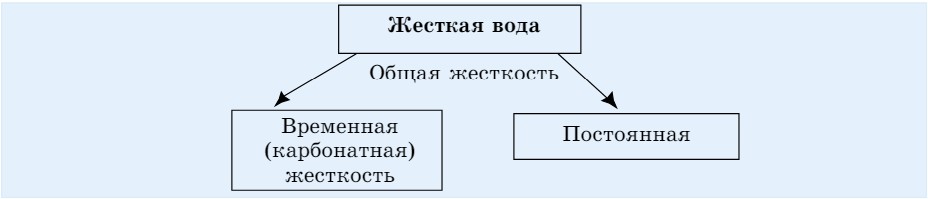
Жесткость воды бывает двух видов: временная и постоянная (схема 11).
Схема 11. Жесткость воды

В настоящее время для устранения жесткости воды применяются ионообменные смолы.
Это интересно!
В настоящее время для профилактики кариеса применяются фторсодержащие пасты (специальные добавки NаF, ZnF2, СаF2). Под воздействием этих соединений на эмали зубов образуются фторапатиты (Са10R2(РО4)6)(R-ОН-, Сl-, F-), они устойчивы к действию кислот и обладают бактерицидными свойствами.

Это интересно!
Мел, мрамор, известняк - все эти вещества представлены одной формулой - СаСО3. Состав твердого мрамора, пригодного для создания скульптур, и аморфного мела, оказывается, одинаковый!
Лабораторный опыт №10
Определение жесткости воды
Цель: знать понятие «жесткость воды» и способы ее устранения.
| Реактивы | Оборудование, химическая посуда |
| Вода, раствор карбоната натрия | Пробирки |
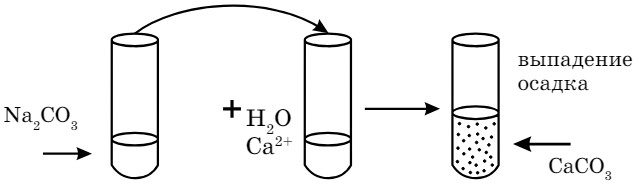
Возьмите две пробирки с жесткой водой (с ионами Са2+). Одну пробирку начинайте кипятить. Что произошло? В другую налить раствор карбоната натрия. Проведите наблюдение, сделайте вывод.
Вопросы и задания
- Какую жесткость устраняют кипячением воды?
- Почему добавили соду во вторую пробирку? Какую жесткость устраняют с помощью этого реактива?
- Напишите свои наблюдения и уравнения проделанных опытов в лабораторный журнал. Сделайте соответствующие выводы.
ДЕЛАЕМ ВЫВОДЫ
- Вода — универсальный растворитель, основа жизни.
- В зависимости от температуры и давления вода может существовать в трех агрегатных состояниях: газообразном, твердом и жидком.
- Вода — уникальное соединение. Плотность льда меньше плотности воды в жидком состоянии, поэтому лед плавает на поверхности воды, так как при температуре 4°С р(Н2О) = 1 г/мл.
- Вода взаимодействует с активными металлами, их оксидами.
