Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 27
§53. ОКСИДЫ УГЛЕРОДА
Какие оксиды углерода вы знаете? К каким оксидам они относятся? Какой из оксидов углерода (II, IV) тяжелее воздуха?
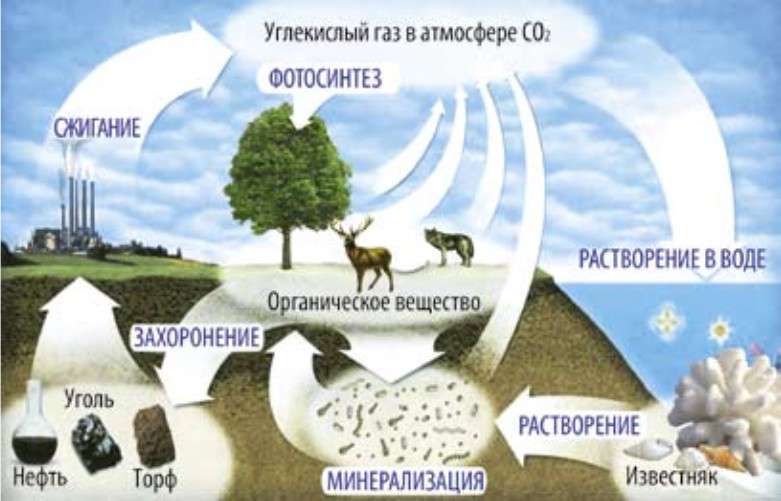
Углерод образует два оксида: угарный газ СО и углекислый газ СО2 (диоксид углерода), которые соответствуют двух- и четырехвалентному состоянию атома углерода.
Оксид углерода (II) — угарный газ СО.
Впервые он был получен французским химиком Жаком де Лассаном в 1776 году при нагревании оксида цинка с углем.
Нахождение в природе. В естественных условиях, на поверхности Земли, СО образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, например, при лесных и степных пожарах.
В атмосфере СО является продуктом ряда реакций с участием метана и других углеводородов. Основным антропогенным источником СО служат выхлопные газы двигателей внутреннего сгорания.
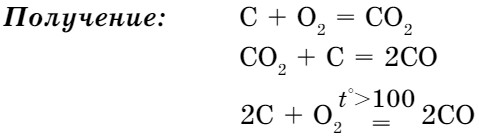

Физические свойства. Оксид углерода (II) — бесцветный, плохо растворимый в воде ядовитый газ, чуть легче воздуха (Мr=28). Он называется угарным газом, потому что связывает ион железа в молекуле гемоглобина крови, вызывая тем самым удушье, его предельно допустимая концентрация (ПДК) = 2%. В выхлопных газах двигателей внутреннего сгорания обнаружено СО (рис. 70). Признаки отравления угарным газом: кровь становится алой, головокружение,
иногда потеря сознания. В первую очередь человека необходимо вывести на свежий воздух.
Химические свойства. Угарный газ СО — несолеобразующий оксид. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами. При нагревании он восстанавливает металлы из их оксидов:
СuО + СО = Сu + СО2
Оксид углерода (II) на воздухе горит голубоватым пламенем:
2СО + О2 = СО2
Оксид углерода (IV) — углекислый газ СО2. Он бесцветный, без запаха, тяжелее воздуха (D (возд.) = 1,52).
Оксид углерода не поддерживает горения. Он используется при огне- тушении. Выделяется при дыхании животных и человека. Из-за того что углекислый газ тяжелее воздуха, он накапливается в подвалах, шахтах, колодцах. Углекислый газ легко переходит в жидкое (при давлении 50 атм.), а затем в твердое состояние («сухой лед»). Углекислый газ, растворенный в воде, придает воде кислый привкус (рис. 71).
Графическая формула: О = С = О
Концентрация углекислого газа в атмосфере Земли составляет 0,039%. При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации до 3% у человека наблюдается учащенное дыхание, более 10% — потеря сознания и даже смерть.
Повышение концентрации углекислого газа в атмосфере вызывает «парниковый эффект», что приводит к повышению температуры и таянию ледников. Концентрация углекислого газа в атмосфере растет из-за автомобильного транспорта, количество которого увеличивается из года в год.

Получение:
- при сгорании углерода:
С + O2 = CO2
- при разложении карбонатов:
CaCO3 = CO2↑ + CaO
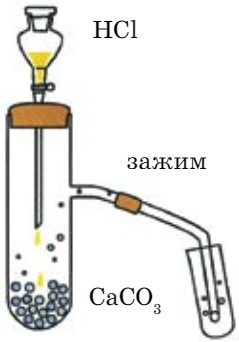
- из карбонатов под действием сильных кислот (рис. 73): CaCO3 + 2HCl = CO2↑ + CaCl2 + H2O
Это лабораторный способ получения СО2.
- при разложении основных солей:
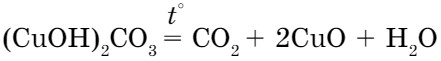
- при горении органических веществ:
CH4 + 2О2 = CO2 + 2H2O
Запомни! Кожа, хотя и в незначительной мере, участвует в обмене газов. Человек за сутки через кожу выделяет 7-9 г СО2 и поглощает 3-4 г кислорода. Поэтому кожу надо содержать в чистоте.
Химические свойства. CO2 — кислотный оксид, ему соответствует угольная кислота Н2СО3, которая существует только в растворе CO2. Вступает в следующие реакции:
- с основными оксидами образует соли: CO2 + CaO = CaCO3
- с растворимыми основаниями образуются соль и вода:
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Гидроксид кальция (известковая вода) является реагентом на углекислый газ (выделяется белый осадок). Помутнение известковой воды - качественная реакция на CO2.
- при избытке углекислого газа карбонат превращается в растворимую кислую соль:
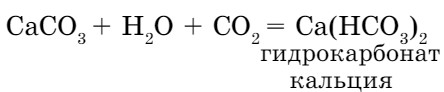
- с водой образуется слабая, неустойчивая угольная кислота:
CO2 + H2O = H2CO3
Применение. Углекислый газ СО2 применяется при тушении пожаров, в производстве прохладительных напитков, в холодильных установках и других областях.
Запомни!
Атмосфера планеты Венера на 95% состоит из СО2.
Существует ли сухой лед? Да. Это углекислый газ, который при температуре -78,5°С превращается в твердое состояние, а при нагревании сразу переходит в газообразное состояние. Это явление называется возгонкой (сублимацией). В составе выдыхаемого нами газа содержится 4% СО2. Углекислый газ применяется в производстве газированной воды, а сухой лед — для охлаждения мороженого.
Угарный, углекислый газы; ПДК угарного газа, метан, физические и химические свойства оксидов углерода, качественная реакция на СО2.
А
- Напишите уравнения реакций, с помощью которых можно осуществить следующие правращения:
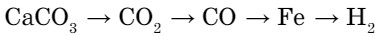
- Рассмотрите рисунок 72 и объясните, как происходит круговорот углерода в природе. Подготовьте эссе и презентацию на эту тему.
В
- Во сколько раз углекислый газ тяжелее угарного газа?
Ответ: в 1,57 раза.
- Определите массу, число молекул, количество вещества углекислого газа объемом 67,2 л (н. у.).
Ответ: п = 3 моль, N = 1,806 • 1024, т = 132 г.
- Напишите графические формулы следующих солей: CaCO3, Na2CO3, NaHCO3.
С
- Какой объем СО2 (н. у.) выделится из огнетушителя, содержащего 40 л 8%-ного раствора (p=1,58 г/мл) гидрокарбоната натрия NaHCO3?
Ответ: 1,344 м3.
- Рассчитайте объем воздуха (объемная доля О2 в воздухе 20%) необходимого для сжигания 20 л угарного газа. Определите объем образующего углекислого газа.
Ответ: 50 л воздуха, 20 л СО2.
- Рассчитайте массу 5%-ной соляной кислоты, которая может вступать во взаимодействие с 8 г гидрокарбоната натрия (NaHCO3). Сколько граммов поваренной соли при этом образуется?
Ответ: 69,52 г HCl, 5,57 г NaCl
Практическая работа №7
Получение углекислого газа и изучение его свойств
Цель: получить углекислый газ, доказать его наличие и изучить свойства.

Ход работы
- В пробирку с газоотводной трубкой положите кусочки мрамора и налейте раствор соляной кислоты, наблюдайте выделение газа (рис. 73).
- Наполните два сухих стакана углекислым газом. Каким способом его можно собирать? Наполненность проверьте горящей лучиной и затем закройте стеклянными пластинками.
- В сухой стакан бросьте кусочек ваты, смоченной спиртом, и подожгите его горящей лучинкой.
- Затем возьмите стакан с углекислым газом и осторожно перелейте в стакан, где горит вата? Что происходит?
- В стакан, наполненный углекислым газом, поместите подожженную магниевую ленту, держа ее шипца- ми. Наблюдайте за горением магния.
- Продукты реакции залейте разбавленным раствором соляной кислоты. Что остается на дне стакана?
Вопросы и задания
- Напишите все уравнения реакций, определите типы реакций.
- К каким оксидам относится углекислый газ?
- Можно ли собирать углекислый газ методом вытеснения воды? Ответ мотивируйте.
- Углекислый газ тяжелее или легче воздуха? На каких этапах работы вы это наблюдали?
ДЕЛАЕМ ВЫВОДЫ
- Углерод встречается в четырех аллотропных видоизменениях (алмаз, графит, карбин). Фуллерен - это искусственная модификация углерода, не существующая в природе.
- В соединениях углерод проявляет валентность II, IV (СН4, СО, СО2).
- СО - угарный (ядовитый) газ, несолеобразующий оксид. СО2 - кислотный оксид.
- Углекислому газу соответствует угольная кислота Н2СО3. Она непрочная, разлагается. Соли этой кислоты называются карбонатами.
- Активированный уголь - хороший адсорбент.
Глава XIII. ВОДА
§54. ВОДА В ПРИРОДЕ
Что вы знаете о воде? Где она встречается? Для чего нужна вода? Как можно получить чистую воду?
Вода — химическое вещество, с которым вы знакомы с рождения.
Вода — основа жизни, самое распространенное на Земле вещество. Вода занимает 3/4 поверхности земного шара. Организмы человека и животных на 65—70% состоят из воды, а в растениях ее содержание достигает 90%. В зависимости от давления и температуры вода может находиться в жидком, твердом и газообразном состоянии в виде тумана, облака, дождя, росы, льда и т. д.
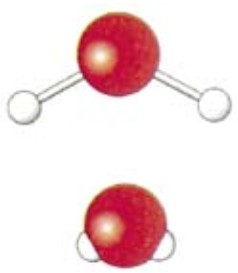
Химическая формула воды - Н2О (рис. 74); структурная формула Н - О — Н, молярная масса - 18 г/моль.
Химический состав воды
- качественно: Н и О - атомы водорода и кислорода;
- количественно: т (Н) : т (О) = 1 : 8;
- v(H) : v(O) = 2 : 1 два атома водорода и один атом кислорода.
Физические свойства воды. Чистая вода - бесцветная жидкость без запаха и вкуса. При нормальном давлении кипит при 100°С и замерзает при 0°С, превращаясь в лед (р = 0,92 г/см3) и увеличиваясь в объеме на 9%. Лед всплывает на поверхность, так как р (Н2О) = 1 г/см3 при 4°С.
Если глубина слоя воды превышает 5 м, то она кажется голубой.
Теплоемкость воды очень высокая, поэтому в знойный летний день возле водоемов всегда прохладно. Поглощенное за летний период тепло вода постепенно отдает в зимнее время в окружающее пространство, смягчая климат Земли; задерживает до 60% теплового излучения нашей планеты, не давая ей охлаждаться. По этой причине над поверхностью озер и рек в холодное зимнее время стоит туман.
Природная вода всегда содержит нерастворимые и растворимые примеси. В морской воде примерно 3,5% растворенных солей, а в проточной и подземной воде - большое количество солей магния и кальция. В дождевой и талой воде примеси в основном представлены растворенными газами СО2, SO2 и пылью.
Способы очистки воды. Они зависят от того, какими примесями и насколько она загрязнена. От нерастворимых примесей воду очищают с помощью отстаивания и фильтрования. От растворимых примесей - способом перегонки. Чистая, без примесей, вода называется дистиллированной (рис. 75).
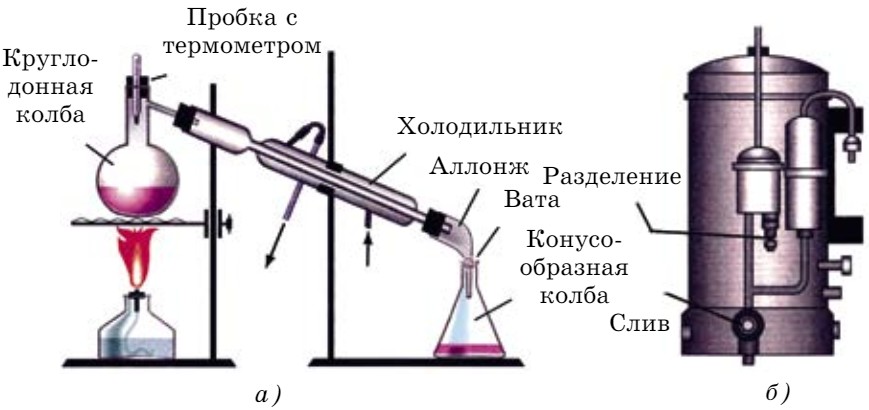
Питьевую воду получают путем очистки природной воды. Очистка природных вод — основная проблема водоснабжения мегаполисов. Для этого отфильтрованную воду направляют в отстойники, где происходит оседание неотфильтрованных частиц. Затем вода направляется на вторичную очистку. Ее обрабатывают хлором, иногда озоном для уничтожения бактерий. Все эти операции выполняются на специально оборудованных площадках водоочистительных станций (рис. 76).
Сточные воды крупных промышленных предприятий, отходы сельскохозяйственных комплексов также требуют дополнительной очистки. Их
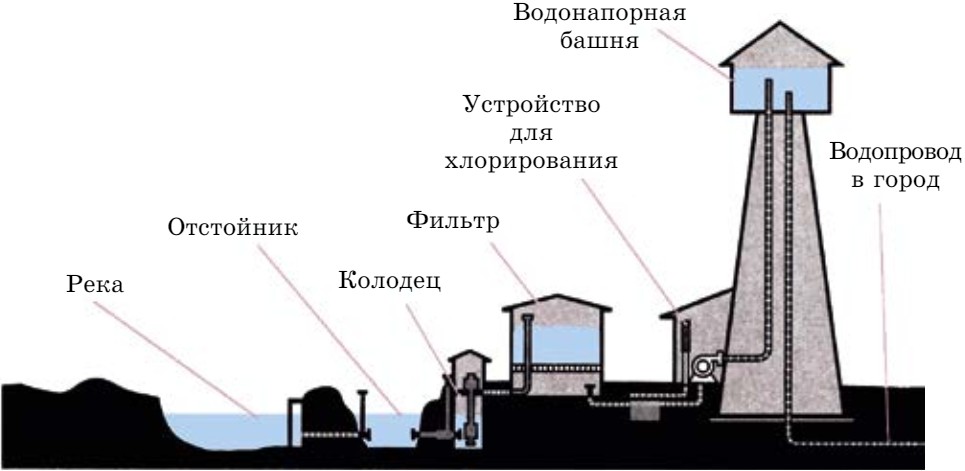
нельзя сбрасывать в водоемы, и за этим строго следят органы экологического контроля.
Дистиллированная вода по составу близка к дождевой воде. Она используется при изготовлении лекарственных препаратов, а также в научноисследовательских целях.
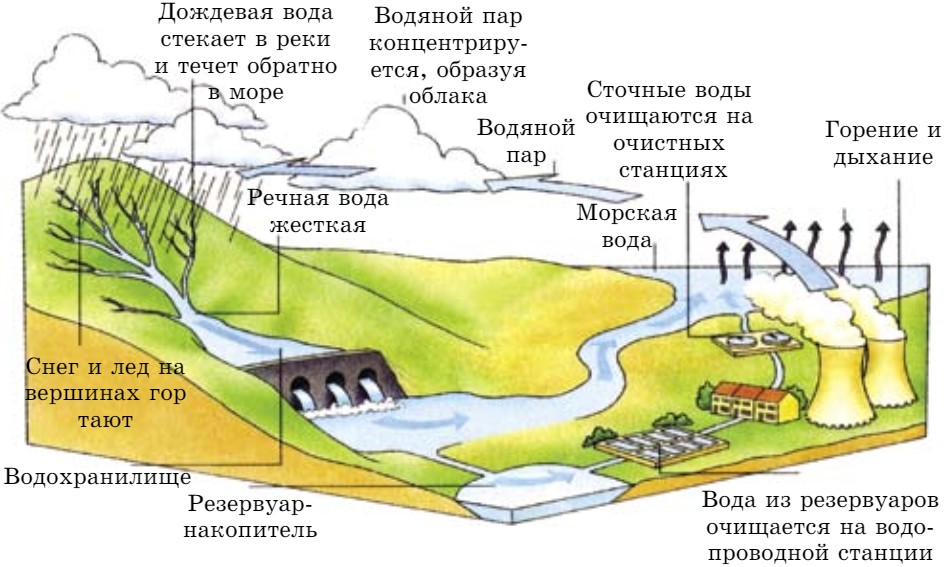
Атмосфера постоянно насыщается парами воды, которая испаряется с поверхности морей, рек, ледников, почвы и листьев растений. Избыток поступивших в нее паров конденсируется на взвешенных пылинках, образуя дождь и снег. Выпавшие осадки, собираясь в реках, озерах и подземных водах, попадают в моря.
С древнейших времен на нашей планете совершается такой круговорот воды: море → атмосфера ч дождь или снег → море (рис. 77).
Всевозможные экологические катастрофы связаны с нарушением круговорота воды. Например, попавшие в воду нефтепродукты быстро растекаются по ее поверхности, уменьшая тем самым испарение и задерживая круговорот воды.
На территории Казахстана насчитывается 85 022 реки и временных водотока, в том числе 84 694 реки длиной 100 км, 305 — до 500 км, 23 реки длиной свыше 500—1000 км. Ертис — наиболее многоводная река Казахстана. Его длина в пределах РК составляет 1700 км (общая длина 4248 км). Вторая по величине река Сырдария длиной 1400 км в пределах республики (общая 2219 км). Река Иле в пределах РК 815 км (1001 км). Наиболее значительные реки РК - Жайык, Ертис, Тобол, Иле, Шу, Торгай, Сарысу, Талас, Нура, Эмба и др.
В Казахстане имеется 48 262 озера: Каспийское, Аральское моря, Бал- каш, Тениз, Алаколь, Маркаколь, Зайсан и др. Более подробно о водных ресурсах РК вы узнаете при изучении «Физической географии Казахстана».
Вода — обыкновенное чудо
Главное из природных богатств - это вода.
Вода вездесуща. Это единственное вещество, которое существует на Земле в трех агрегатных состояниях. Она находится во всех земных сферах, не только в гидросфере, т. е. в океанах, морях, озерах, болотах, реках, ледниках, подземных водах, но и в атмосфере - на поверхности суши и в воздухе, в литосфере - в почве и в земной коре и в биосфере - в организмах всех животных и растений.
Вода — среда жизни. Одно из удивительных физико-химических свойств воды - это высокая растворяющая способность. Вода является инертным растворителем, т. е. химически не изменяющимся под воздействием тех веществ, которые растворяет. Поэтому вещества, необходимые для живых тканей, попадают в организм с водой в малоизмененном виде.
Вода - основной источник кислорода, входящего в состав атмосферного воздуха. Растения выделяют кислород в процессе фотосинтеза.
Вода регулирует климат. Исключительно высокая теплоемкость воды привела к тому, что океан стал регулировать климат Земли.
Вода формирует поверхность Земли. Реки, ручьи размывают горы, образуя широкие долины или глубокие ущелья, меняя таким образом ландшафт.
Вода — источник электрической энергии. Гидроэлектростанции превращают механическую энергию водного потока в электрическую.
Главное преимущество ГЭС перед тепловыми электростанциями (ТЭС), в которых используется энергия сжигаемого топлива, - это постоянное самовозобновление источника энергии, поэтому стоимость эксплуатации дешевле.
Вода — самая оживленная «трасса» для мореходных судов и танкеров.
Вода — целитель. Из-за высокой теплоемкости и большой теплопроводности она хорошо растворяет соли и газы и при купании благотворно влияет на кожный покров, улучшает кровообращение.
Вода — «землекоп». Гидромеханизация - подача воды под большим давлением. Под давлением в 6-12 атм вода легко размывает рыхлые горные породы, а при давлении 15-20 атм - более твердые. Гидромеханизация широко применяется на золотых приисках и угольных шахтах.
Вода измеряет. Человек выбрал воду в качестве эталона для измерения температуры, массы, количества тепла, времени, высоты местности.
В Древней Греции для измерения времени использовали водяные часы. Наверное, там и родилось выражение «ваше время истекло».
Вода тушит пожары. Вода не горит, потому что является продуктом сгорания водорода. При тушении пожара вода охлаждает горящие предметы, преграждает доступ кислорода из воздуха к очагу возгорания.
Вода — разрушитель. При замерзании вода расширяется. Превращаясь в лед, вода «рвет» даже гранитные валуны на части. Отсюда и пословица: «Вода камень точит».
Вода и магия. С древних времен воде приписывали магические свойства. Это отразилось, например, в христианском обряде крещения, совершаемом в знак приобщения к религии Христа. Мусульмане перед пятикратным намазом совершают омовение.
Погружению в воду или обливанию во многих религиях придают значение не только физического, но и нравственного очищения.
Иногда о человеке, предугадавшем события, говорят: «Как в воду глядел».
Вода угрожает. Если воды оказывается катастрофически много или мало, то происходит стихийное бедствие (наводнение, засуха).
В настоящее время человек мужественно и умело борется со стихией, возводя плотины и дамбы, строя водохранилища. В Казахстане множество водохранилищ, самые крупные: Буктарминское, Капшагайское, Шардаринское и Коксараинское.
Вода является для человека более ценным природным богатством, чем нефть и газ, железо и уголь и т. д., ибо она незаменима.
Что означают эти слова: акварель, акватория, аквафор, акваланг, аквапарк?
Объясните каждое название.
Знаешь ли ты?
Что такое «мертвая вода»? Это D2O или Т2О. Цвет, вкус и запах у них, как у воды, но они тормозят процесс обмена веществ, в клетке происходят необратимые процессы, что способствует быстрому старению организма. У «мертвой воды» температура плавления и кипения, а также плотность выше, чем у обыкновенной воды, а растворимость ниже.
А
1. Какая вода без примесей:
- дождевая вода
- дистиллированная вода
- питьевая вода
- морская вода
- речная вода?
- Назовите температуру кипения и замерзания воды при давлении 101,3 кПа.
- Почему используют воду для тушения пожаров?
В
- Вода при замерзании расширяется. Как меняется при этом плотность воды?
- Учитывая содержание воды в организме человека, рассчитайте массу и количество воды в вашем теле.
- По рисунку 77 «Круговорот воды в природе» составьте эссе. Подготовьте на эту тему презентацию.
С


