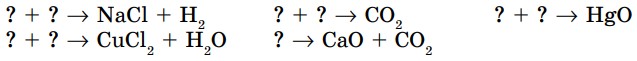Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 5
§8 СООТНОШЕНИЕ МАСС РЕАГИРУЮЩИХ ВЕЩЕСТВ. ЗАКОН ПОСТОЯНСТВА СОСТАВА

Состав вещества можно выразить числом атомов или массовым отношением атомов в молекуле. Например, для молекулы СО2 отношение числа молей атомов v (С) : v (О) = = 1 : 2, а массовые отношения элементов т (С) : т (0) = 12 : 32 = 3 : 8. Или можно взять отношения массовых долей элементов:
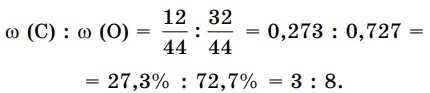
Углекислый газ выделяется при горении топлива, при разложении некоторых сложных веществ или в результате дыхания.
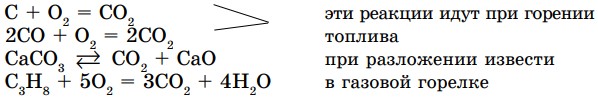
Как вы видите, в молекуле СО2, независимо от способа образования, отношения масс, массовых долей (т, ω) остаются неизменными. На основании этого можно сделать вывод о постоянстве состава образующегося вещества. К этому важному выводу первым пришел французский ученый Ж. Л. Пруст в результате многочисленных исследований на протяжении ряда лет (17991806). Им был открыт закон постоянства состава веществ:
Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
В настоящее время известны вещества с переменным составом, с ними вы познакомитесь позднее.
В формулах веществ молекулярного строения индекс указывает на количество химического элемента в молекуле вещества.
На основе закона постоянства состава вещества можно производить различные расчеты. Рассмотрим следующий пример:
При взаимодействии меди с серой образуется 1 моль сульфида меди (II):
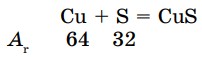
т (Сu) : т (S) = 64 : 32 = 2 : 1
Значит, из 2 г Cu и 1 г S образуется сульфид меди (II).
Проведем два опыта.
- . Возьмем смесь, состоящую из 5 г меди и 2 г серы. После нагревания получим смесь сульфида меди с медью, так как 1 г меди находится в избытке. В смеси содержится 6 г СuS и 1 г Cu.
- . Теперь возьмем по 4 г меди и серы. В этом случае после нагревания образуется смесь сульфида меди и серы, так как 2 г серы остаются неизрасходованными и образуется 6 г сульфида меди.
Проверим результаты опытов математическим путем.

5) Расчет массы меди, которая остается в избытке.
По условию задачи было взято 5 г меди, следовательно, масса оставшейся меди: 5 г Cu, 5 - 4 = 1 г Cu в избытке.
6) Расчет массы сульфида меди:
т (Cu) + т(S) = 4 + 2 = 6 г.
(7) Ответ: 1 г Си в избытке, 6 г CuS.

1) Расчет массы серы, которая остается в избытке:
По условию задачи было взято 4 г серы, значит, масса оставшейся серы:
4 - 2 = 2 г S в избытке.
5) Расчет массы сульфида меди:
По закону сохранения массы веществ 4 г Cu взаимодействует с 2 г S с образованием 6 г СuS.
6) Ответ: 2 г S в избытке, 6 г CuS.
Соотношение масс реагирующих веществ, закон постоянства состава.
А
- Найдите массовые отношения атомов в следующих соединениях: MgO, SO2, SO3, FeO, Fe2O3, Al2O3.
- Найдите отношения массовых долей элементов в данных соединениях: FeO, Fe2O3; P2O3, P2O5; PCl3, PCl5.
В
- Составьте уравнение реакции взаимодействия магния с кислородом. Определите массовые отношения этих элементов.
- Напишите уравнение реакции образования воды из водорода и кислорода. Определите массовые отношения этих веществ.
- Сколько граммов магния и кислорода требуется для получения 10 г оксида магния?
Ответ: 6 г Мg, 4 г О2.
С
- Какое вещество остается в избытке при нагревании смеси, состоящей из 6 г магния и 10 г серы?
Ответ: т(S) = 2 г.
- При нагревании смеси, состоящей из железа и серы, получают смесь:
a) 11 г FeS и 2 г Fе;
б) 11 г FeS и 6 г S.
Рассчитайте соотношения железа и серы в исходных смесях т(Fе): т(S). Ответ: а) т(Fе) : т(S) = 9 : 4; б) т(Fе) : т(S) = 7 : 10
Лабораторный опыт №2
Соотношение масс реагирующих веществ
І вариант.
Цель: определить опытным путем соотношение масс реагирующих веществ, доказать правильность закона постоянства состава и закона сохранения масс.
| Реактивы | Оборудование, посуда |
| 1) раствор сульфата меди (0,5 моль/л). 2) раствор гидроксида натрия (0,5 моль/л). | бюретки (2)7 пробирок (для одной группы) 3) линейка 4) штативы |
Ход работы
- Налейте во все пробирки, закрепленные в штативах, по 5 мл раствора гидроксида натрия.
- С помощью бюретки налейте определенные объемы раствора сульфата меди в таком порядке: 1 мл, 1,5 мл, 2 мл, 2,5 мл, 3 мл, 3,5 мл, 4 мл.
- Через некоторое время в некоторых пробирках образуется осадок, и надо дать ему отстояться.
- Заполните таблицу. Высота осадка будет измерятся линейкой.
| № | V р-ра NаОН (мл) | V р-ра CuSО4 (мл) | h мм |
| 1 | 5 | 1 | |
| 2 | 5 | 1,5 | |
| 3 | 5 | 2 | |
| 4 | 5 | 2,5 | |
| 5 | 5 | 3,0 | |
| 6 | 5 | 3,5 | |
| 7 | 5 | 4,0 |
Вопросы и задания:
- Напишите уравнение реакции.
- Какое объемное отношение растворов достаточно для образования осадка?
- Определите массовые отношения исходных веществ.
- Сделайте выводы: выполняется ли закон постоянства состава и закон сохранения масс.
ІІ вариант.
Цель: определять опытным путем соотношение масс реагирующих веществ.
| Реактивы | Оборудование, посуда |
| Железные опилки, сера кристаллическая | Ложечка или шпатель, технические весы, часовое стекло, спиртовка, спички, штатив с кольцом, фарфоровая чашка, стеклянная палочка, тигель |
Ход работы
- Напишите уравнение реакции взаимодействия железа с серой:
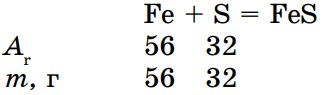
- Определить соотношение масс реагирующих веществ: т (Fе) : т (S) = 56 : 32 = 7 : 4
- Для удобства и экономии реагентов можно брать исходные вещества в соотношении 3,5 : 2, т. е. на технических весах взвесить 3,5 г железа и 2 г серы.
- Закрепить тигель на кольце штатива, нагреть, перемешивая стеклянной палочкой взвешенные железо и серу до образования однородной темной массы сульфида железа (II) (рис. 10).
Вопросы и задания:
- Назовите физические свойства железа и серы.
- Классифицируйте исходные вещества и продукт реакции на простые и сложные.
- Отличаются ли исходные вещества и продукт реакции по физическим свойствам?
- Какова масса полученного продукта?
- Могут ли оставаться примеси железа или серы вместе с продуктом реакции? Как можно определить, есть ли эти примеси?
- Правильность какого химического закона доказана с помощью этого опыта?
§9 ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций.
- Реакции соединения — это реакции, в результате которых из нескольких простых или сложных веществ образуется одно сложное вещество (рис. 10).

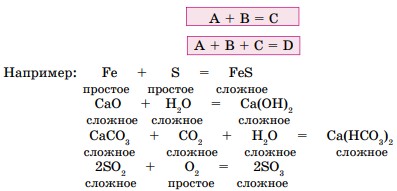
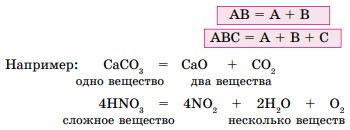
2. Реакции разложения — это реакции, в результате которых из одного сложного вещества образуются два и более веществ - простых или сложных.
3. Реакции замещения - это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном соединении. В результате образуются новые простое и сложное вещества (рис. 11а).

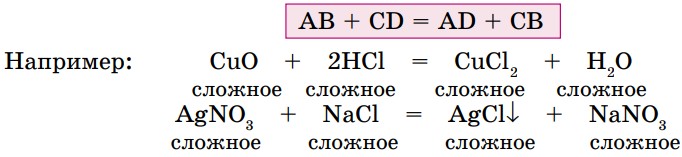
4. Реакции обмена — это реакции, в результате которых два сложных вещества обмениваются своими составными частями и образуются два новых сложных вещества (рис. 11б).
С классификацией химических реакций по другим признакам вы познакомитесь позднее.
Типы химических реакций
А
1. Сформулируйте закон сохранения масс.
2. Какие типы химических реакций вам известны? Дайте определение каждому типу реакций.
В

- Закончите уравнения химических реакций и определите их тип. Расставьте коэффициенты. Вместо знака “?” вставьте формулы соответствующих веществ:
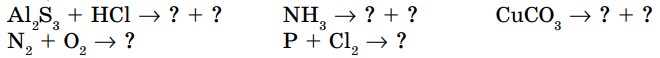
2. Закончите уравнения химических реакций и расставьте коэффициенты, определите тип каждой из них:
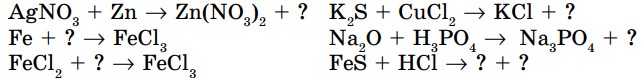
3. Вместо вопросительного знака в схемах химических уравнений вставьте формулы соответствующих веществ. Расставьте коэффициенты и определите тип каждой реакции: