Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 6
§10. ХИМИЧЕСКИЕ РЕАКЦИИ В ПРИРОДЕ И ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВЫХ ОРГАНИЗМОВ И ЧЕЛОВЕКА
Вам известно, что в результате химических явлений одни вещества превращаются в другие, отличающиеся от исходных веществ по составу. Это вы можете наблюдать в окружающей среде каждодневно. Например: ржавление железного гвоздя, потускнение серебряных украшений и предметов кухонной утвари, позеленение тазика из латуни, горение дров и газа на плите. Что общего между ними? Все эти процессы происходят под действием кислорода воздуха, т. е. идет окисление.
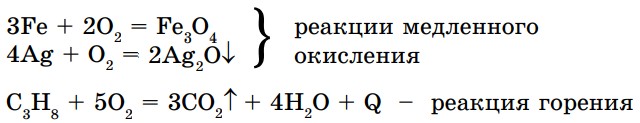
Химия в природе. В природе непрерывно идут реакции образования органических веществ из простых неорганических соединений, т. е. идут реакции синтеза (рис. 12):

Такой процесс идет в зеленых растениях и водорослях. Хлорофилл находится в хлоропластах зеленых листьев, поэтому они окрашены в зеленый цвет.
Во время грозы в летний период воздух становится свежее и чище в результате следующих реакций:
O2 → O + O O + O2 → O3
При разложении кислорода получаем атомарный кислород. Атомарный кислород, соединяясь с молекулой кислорода, образует озон.
Озон - это газ синего цвета с характерным запахом свежести. Накапливается в верхних слоях атмосферы и образует озоновый слой, который выполняет роль щита нашей планеты. Озон защищает Землю от солнечной радиации из космоса и не допускает остывание Земли, поглощая инфракрасное излучение.
Гниение также относится к реакциям окисления. В отличие от горения, гниение - это медленно протекающие процессы. В результате гниения сложные азотсодержащие вещества взаимодействуют с кислородом при участии микроорганизмов. Для того чтобы шел процесс гниения, кроме микроорганизмов, необходимо наличие влаги. Это уникальный, сложный многоступенчатый процесс, позволяющий перерабатывать белки погибших животных и растений в соединения, пригодные к усвоению растениями.
На реакциях, лежащих в основе брожения сахаристых веществ, основаны многие производства, например, хлебобулочных изделий и напитков.
В результате реакции окисления глюкозы образуется углекислый газ, вода и большое количество тепла:
с6н12о6 + 6О2 = 6СО2↑ + 6Н2О + Q
Это является источником энергии, необходимой для физической и умственной деятельности в повседневной жизни человека.
Использование пищевой соды способствует поднятию теста, так как при взаимодействии с органическими кислотами выделяется углекислый газ.
Выделяющийся углекислый газ (СО2) разрыхляет тесто, поэтому булочки получаются мягкими и пышными.
Химия в живых организмах. С точки зрения химика, дыхание - также процесс окисления органических веществ: углеводов, жиров, белков.
Часть энергии, выделенной в результате этой реакции, организм использует для совершения умственной, физической работы.
А вторая часть запасается в организме для того, чтобы можно было использовать ее при синтезе характерных для данного организма белков, углеводов и жиров. Таким образом, энергия, необходимая для жизнедеятельности, получается из питательных веществ, поступающих в организм из окружающей среды.
Антацидные вещества - лекарственные средства для лечения желудочнокишечных заболеваний. Они нейтрализуют соляную кислоту, которая входит в состав желудочного сока.
Химия в быту. Работа двигателей внутреннего сгорания основана на реакции горения углеводородов (топлива).
СnН2n(углеводороды) + 2 + 2пО2 = пСО2 + (п+1)Н2О
Вы, наверное, заметили, что на стенках чайника через некоторое время образуется накипь. При этом идет реакция разложения солей магния и кальция, обусловливающих временную жесткость воды. В результате этих реакций образуются нерастворимые соли кальция и магния.
Из-за накипи выходят из строя нагревательные элементы в стиральных и посудомоечных машинах, утюгах, а также промышленные котлы.
Для очистки чайника от накипи достаточно прокипятить воду, в которую добавлена уксусная кислота.
Для этой цели можно использовать и лимонную кислоту.
«Гашение» соды уксусом - часто наблюдаемая на кухне реакция: сода + уксусная кислота → соль + вода + углекислый газ
Хозяйственное мыло не мылится в жесткой воде, т. к. идет реакция обмена с солями кальция и магния и образуется нерастворимая соль, которая «всплывает». Это объясняется тем, что натриевые соли органических кислот растворимые, а кальциевые, магниевые соли - нерастворимые в воде.
Санатории для больных туберкулезом обычно расположены в сосновых борах. Почему? Потому что в хвойных растениях содержится соединение, которое при окислении озоном (после грозы) выделяет атомарный кислород, который обладает дезинфицирующим и отбеливающим свойствами.
3O2 →2О3;
O3→ O2 + O
Еще одно интересное природное явление - образование в пещерах сталактитов и сталагмитов - это осадок карбоната кальция СаС03. Сталактиты растут сверху вниз как сосульки, а сталагмиты - снизу вверх (рис. 13).

Химия дает человечеству огромные возможности и силы, но только она требует грамотного и ответственного отношения к ней. За день в мире происходят тысячи различных (опасных для человечества, в то же время интересных) химических реакций. Не зря говорится в изречении М. В. Ломоносова: «Широко распространяет химия руки свои в дела человеческие».
А
- Назовите известные вам химические реакции, идущие в природе, быту и в живых организмах.
- Назовите условия и признаки протекания реакций в природе.
В
- При «гашении» негашеной извести (СаО) водой образуется гашеная известь (Са(ОН)2). Напишите уравнение реакции. Определите тип реакции.
- Определите типы химических реакций:
CaCO3 → CaO + CO2
C + O2 → CO2
H2 + O2 → H2O
C
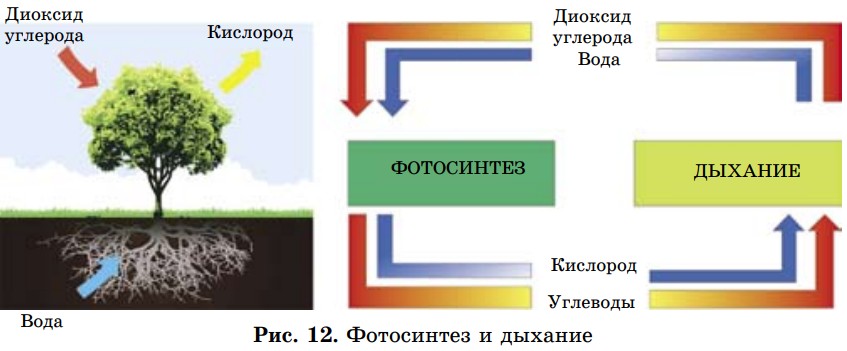
- Как изменится под воздействием «кислых» дождей масса мраморной скульптуры? Какой газ выделится? Напишите уравнение реакции, определите тип реакции.
- Образование кислотных дождей в природе. Рассмотрите рисунок 14 и составьте рассказ об этом.
Словарь по темам «Составление уравнений химических реакций», «Типы химических реакций»
| № п/п | Русский | Казахский | Английский |
| 1. | закон сохранения массы веществ | зат массасының сақталу заңы | law of conservation of mass |
| 2. | закон постоянства состава | құрам тұрақтылығы заңы | law of definite proportions |
| 3. | реакция соединения | қосылу реакциясы | composition reaction |
| 4. | реакция разложения | айырылу реакциясы | decomposition reaction |
| 5. | реакция замещения | орын басу реакциясы | displacement reaction |
| 6. | реакция обмена | алмасу реакциясы | exchange reaction |
ДЕЛАЕМ ВЫВОДЫ
- Обозначения качественного и количественного состава простых и сложных веществ с помощью символов элементов и индексов называются химическими формулами.
- Химическое уравнение — условная запись химической реакции с помощью химических формул и знаков.
- По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций: реакция соединения, реакция разложения, реакция замещения, реакция обмена.
- Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Эта формулировка называется законом сохранения масс веществ.
Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
Глава III. ХИМИЧЕСКАЯ АКТИВНОСТЬ МЕТАЛЛОВ
§11. РЕАКЦИИ МЕТАЛЛОВ С КИСЛОРОДОМ И ВОДОЙ
Что вы знаете о ржавлении железа? Расскажите о разрушении металлов? Как вы думаете, как можно защитить металлы от разрушения? Где применяются металлы? Приведите примеры из жизни.
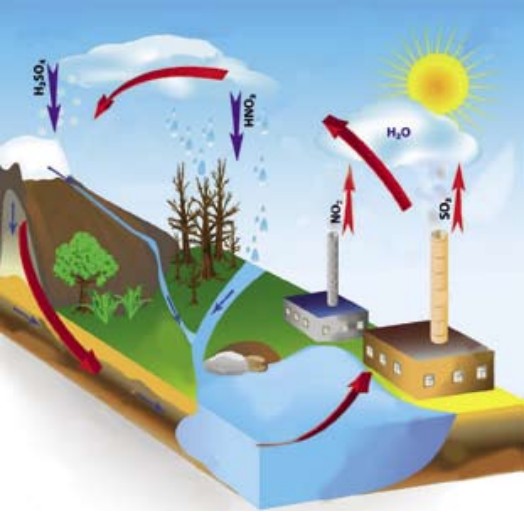
Металлы мы часто применяем в повседневной жизни. Это алюминий, медь, железо, золото, серебро и т. д. Алюминий и медь применяются для изготовления проводов. Алюминиевой фольгой упаковывают лекарства. В домашнем обиходе вы часто встречаете алюминиевую посуду и упаковки для напитков. Но больше всего применяется железо для изготовления различных металлоконструкций, трубопроводов, деталей машин и т. д. Этот металл от воды и кислорода воздуха приходит в негодность, изменяет цвет и тускнеет. Железо покрывается ржавчиной красно-бурого цвета. Железо + вода + воздух → ржавчина. Такой химический процесс называется коррозией (от лат. сorrodere - разъедать).
Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
Поверхность алюминия покрывается оксидной пленкой, которая препятствует коррозии:
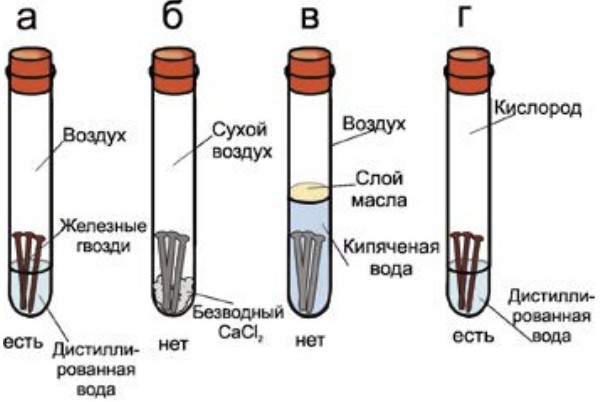
4А1 + 3O2 = 2А12О3
Химические активные металлы легко окисляются кислородом воздуха (Na, Mg, Са). Железо и медь окисляются только при нагревании:
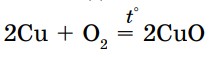

А золото и некоторые благородные металлы вообще не окисляются кислородом.
Рассмотрите рисунок 15 и сами сделайте выводы.
Ежегодно четвертая часть всего производимого металла из-за коррозии приходит в негодность (рис. 16).
Знаменитую Эйфелеву башню в Париже красили уже 18 раз, в результате чего ее масса увеличилась на 70 т.
Коррозия вызывает серьезные экологические катастрофы. Из разрушенных трубопроводов может быть утечка газа, нефти, опасных химических продуктов.
Это приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
Металлы защищают от коррозии нанесением покрытий на поверхность изделия: окраска металла лаками, красками, эмалями. Но это покрытие недолговечно. Предохраняют металл покрытием другого металла, менее подверженного коррозии. Это — золото, серебро, хром, никель, олово, цинк и др. В повседневной жизни часто применяют оцинкованные ведра, никелированные кровати. Для консервных банок применяют железо, покрытое оловом. Такое железо называют белой жестью. Белую жесть получают в г. Темиртау Карагандинской области на металлургическом заводе. Можно уменьшить коррозию железа, добавляя другие металлы: никель, хром, молибден. Таким образом, получают сплав, который называется нержавеющей сталью. Из этой стали изготавливают столовые приборы, трубы и другие изделия.
Это интересно!
Олово — достаточно редкий, но очень полезный металл. Известно, что его начали добывать раньше, чем железо.
Олово — это мягкий белый металл, который можно сплавлять с медью, чтобы получить бронзу. Олово — один из первых освоенных человеком металлов. Оно не подвержено коррозии, поэтому из него делают тару для упаковки. Слой олова, нанесенный на другие металлы, делает их поверхность гладкой и блестящей. Банки для хранения консервов и напитков также делают из тонкого стального листа, покрытого оловом.
Взаимодействие воды с некоторыми металлами (рис. 17).
- Взаимодействие воды с активными металлами в обычных условиях идет очень интенсивно.
При этом протекают реакции замещения:
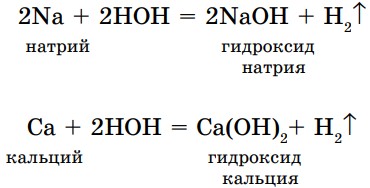

При проведении таких опытов необходимо соблюдать меры предосторожности.
- При взаимодействии металлов средней активности с водой вместо щелочи выделяется оксид металла:
Мg + НОН = МgО + Н2↑
Малоактивные металлы (Си) с водой не реагируют.
Коррозия, ржавчина, защита от коррозии, белая жесть, алюминиевая фольга, сплав.
А
1. Что такое коррозия? Дайте определение. Какая часть металла ежегодно теряется из-за коррозии?
- К какому типу реакции относится взаимодействие металлов с кислородом?
- К какому типу реакции относится реакция взаимодействия металлов с водой?
- Классифицируйте элементы на металлы и неметаллы: S, Мg, С1, А1, Н, Са, N, О, Аs, Р, Аu, Fе.
В
- Как можно защитить металл от коррозии?
- Чем отличаются металлы и неметаллы по электронному строению атомов?
Составьте формулы оксидов методом «нулевой суммы»:
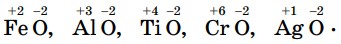
Какой из этих металлов в обычных условиях интенсивно реагирует с водой:
Аu, Мg, Nа, Fе, Са, А1?
С
- Расположите формулы приведенных оксидов по возрастанию в них массовых долей металлов.

- Рассмотрите рис. 15. Сделайте выводы.
- Подготовьте эссе о защите металлов от коррозии. Какой вред наносит коррозия народному хозяйству?
Это интересно!
Свинец — тяжелый голубовато-серый металл, который не ржавеет. Он используется в автомобильных аккумуляторах. Свинцовые экраны защищают людей от опасной радиации. Но свинец токсичен и ядовит для человека.
Демонстрация №2
Взаимодействие активных металлов с холодной и горячей водой
Демонстрацию выполняет учитель, учащиеся наблюдают, делают выводы.
Цель: узнать, как реагируют активные металлы с холодной и горячей водой.
Реактивы
Натрий N8, кальций Са, вода Н2О, индикаторы — фенолфталеин, метилоранж
Химическая посуда, оборудование
Кристаллизатор, скальпель, фильтровальная бумага, пинцет
Обрежьте кусочек натрия скальпелем, высушите фильтровальной бумагой. Высушенный кусочек натрия следует бросить в кристаллизатор с холодной, а затем горячей водой. Наблюдать за ходом реакции через стекло вытяжного шкафа. Такую же реакцию проделать и с металлическим кальцием. Испытать полученные растворы двумя индикаторами.
Задание
- Сравните интенсивность выделения газа с холодной и горячей водой.
- Какой из этих металлов более активный?
- Напишите уравнения реакций.
