Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 7
§12. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КИСЛОТАМИ. РЯД АКТИВНОСТИ МЕТАЛЛОВ
Что такое кислоты? Какие кислые вещества вы встречали в природе?
В соответствии с определением кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Это можно проверить на опыте.
В четыре пронумерованные пробирки нальем одинаковое количество раствора соляной кислоты и добавим: в первую пробирку — Мg; во вторую — Zn; в третью - Sn; в четвертую - Сu.
Как видим, не все металлы могут взаимодействовать с кислотами и скорости их взаимодействия различны (рис. 18).
На основании интенсивности взаимодействия металлов с кислотами русским ученым Н. Н. Бекетовым был составлен ряд активности металлов:
Li K CA Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
При использовании ряда химической активности нужно помнить следующие правила:
- металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды.
- активность металлов в этом ряду снижается слева направо (→).
- только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот (НС1, Н2 SO4 разб.) (рис. 18):

Протекает реакция замещения.
Металлы, стоящие в ряду активности после водорода, не реагируют с разбавленными растворами кислот (табл. 6).
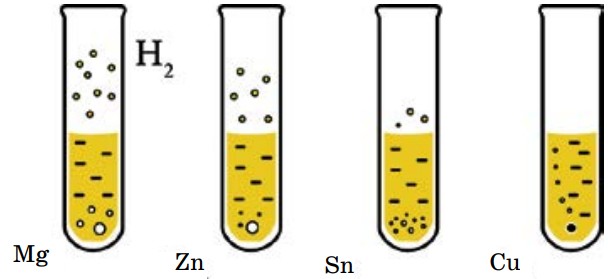
Таблица 6. Сравнительная активность взаимодействия некоторых металлов с кислотами
| № пробирки | Металл | Кислота | Условия протекания | Признак реакции | Уравнение реакции |
| 1 | Mg | HCl | Реакция начинается сразу | Выделяется газ | Mg + 2HCl = = MgCl2 + H2↑ |
| 2 | Zn | HCl | Реакция идет с умеренной скоростью | Выделяется газ | Zn + 2HCl = = ZnCl2 + H2↑ |
| 3 | Sn | HCl | Реакция начинается после нагревания | Выделяется газ | Sn + 2HCl = = SnCl2 + H2↑ |
| 4 | Cu | HCl | Реакция не протекает даже при нагревании | Cu + HCl ≠ |
Лабораторный опыт №3
Взаимодействие металлов с растворами кислот
Цель: исследовать реакции различных металлов с растворами кислот и сделать вывод о существовании химически инертных металлов.

Налейте в четыре пробирки раствор соляной кислоты. В одну из пробирок насыпьте порошка магния, в другую — поместите гранулы цинка, в третью — опилки железа, в четвертую — стружки меди.
Вопросы и задания
Что вы наблюдаете? Обратите внимание на интенсивность протекания реакций. Напишите уравнения реакций. Сделайте соответствующие выводы.
Знаешь ли ты?
Может ли железо не подвергаться коррозии? Да, если оно очень чистое. Например, в Дели (Индия) находится Кутубская колонна высотой 7 м, массой 6,5 т. Она установлена в IX в. до н. э., в ее составе 99,72% Fe. До сих пор эта колонна не подверглась коррозии.
Ряд активности металлов.
А
- Как металлы реагируют с кислотами?
- Определите элементы, для которых приведены схемы электронного строения атомов:
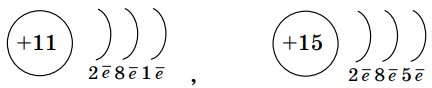
- Какой из элементов, приведенных в 1-м вопросе, склонен отдавать, а какой - принимать электроны? Почему?
- Для элементов, определенных в 1-м вопросе, укажите, как образуются ионы и составьте формулу вещества, образуемого этими ионами по методу «нулевой суммы».
В
- Рассчитайте массовые доли элементов в соединении, для которого составили формулу в пункте А 4.
- К какому типу реакции относится взаимодействие металлов с кислотами?
С
- Используя ряд химической активности металлов, определите, какие из представленных реакций идут:
Cu + Н2SO4(разб.) → ? + ?
Mg + HCl (разб.) → ? + ?
Al + HCl (разб.) → ? + ?
- Дополните уравнение реакции и рассчитайте массовые отношения исходных веществ:
Fe + ? → FeCl2 + ?
Al + ? → Al2(SO4)3 + ?
§13 ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С РАСТВОРАМИ СОЛЕЙ
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (II) железо вытесняет медь (рис. 19):
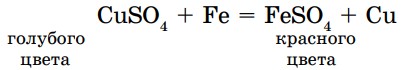
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает (FеSО4 + Си ≠ ), потому что медь в ряду активности металлов находится после железа, поэтому не вытесняет его.
Схема реакций замещения выглядит следующим образом:
соль + активный металл = новая соль + новый металл (менее активный)
Реакции такого типа протекают при следующих условиях:
- взаимодействующие соли должны быть растворимыми в воде;
- более активный металл вытесняет из соли менее активный металл.
Рассмотрите рисунки. Сделайте выводы и напишите уравнение реакции.

Демонстрация №3
Вытеснение металлов из растворов солей
Цель: понимать, что более активный металл вытесняет менее активный металл из растворов его солей.


В пробирку поместите гранулы цинка и налейте раствор сульфата меди. В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа №1
Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.

Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “+”, если не идет реакция - знак “-”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.
| Растворы солей | Металлы | ||||
| Сu | Fе | Zn | Sn | Рb | |
| СuSO4 | |||||
| FеС13 | |||||
| ZnSО4 | |||||
| SnС12 | |||||
| Pb(NO3)2 | |||||
| Количество протекающих реакций | |||||
Вопросы и задания
- По проведенным опытам определите самый активный и самый инертный металлы.
- По результатам опытов составьте свой ряд активности металлов.
- Сопоставьте ваш ряд активности с табличными данными.
- Сделайте прогноз возможности протекания незнакомых реакций, используя ряд активности металлов Бекетова. Закончите уравнения протекающих реакций:
- А1С13 + Zn → ? + ?
- СuSО4 + А1 → ? + ?
- PЬ(NО3)2 + Fе → ? + ?
- Сu + НgС12 → ? + ?
- Sn + FеSО4 → ? + ?
- Fе + SnС12 → ? + ?
Словарь к главе ІІІ
| № п/п | Русский | Казахский | Английский |
| 1. | Коррозия металлов | Металдар коррозиясы | Corrosion of metals |
| 2. | Благородные металлы | Бағалы металдар | Precious metals |
| 3. | Химическая активность металлов | Металдардың химиялық белсенділігі | Chemical activity of metals |
| 4. | Химический ряд активности металлов | Металдардың химиялық белсенділік қатары | Chemical activity series of metals |
ДЕЛАЕМ ВЫВОДЫ
- Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
Металлы IА, IIА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
