Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 8
Глава IV. КОЛИЧЕСТВО ВЕЩЕСТВА
§14. КОЛИЧЕСТВО ВЕЩЕСТВА. ЧИСЛО АВОГАДРО. МОЛЯРНАЯ МАССА ВЕЩЕСТВА

Относительная атомная и молекулярная масса
Часто при решении расчетных задач по химии приходится вычислять массу, объем реагирующих веществ или продуктов реакций. Кроме этих величин, в химии используется также величина количество вещества. Как измеряют количество вещества?
Каждое вещество состоит из огромного числа частиц, поэтому для удобства была выбрана единица измерения, содержащая большое число частиц, - моль. Моль — мера количества вещества (атомов, молекул, ионов), обозначается греческой буквой v. Количество вещества представляет собой физическую величину, определяемую числом структурных единиц (атомов, молекул и др).
Из курса физики вам знакомо число Авогадро:
NА = 6,02 . 1023 моль-1.
В одном моль любого вещества число структурных единиц равно числу Авогадро.
Масса одного моль вещества называется молярной массой, обозначается буквой М. Молярная масса вещества (г/моль) численно равна относительной молекулярной массе вещества.
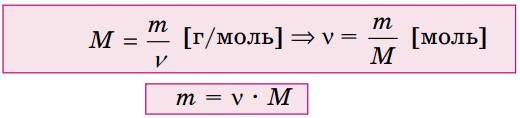
Таблица 7. Величины, характеризующие разные частицы вещества
| Формула вещества | С | н2о | со2 | Nа+ |
| v, моль | 1 | 1 | 1 | 1 |
| Структурная единица | атом | молекула | молекула | ион |
| N | 6,02 • 1023 | 6,02 · 1023 | 6,02 · 1023 | 6,02 · 1023 |
| М | 12 | 18 | 44 | 23 |
| М, г/моль | 12 | 18 | 44 | 23 |
| т, г | 12 | 18 | 44 | 23 |
Рассмотрите внимательно таблицу 7. Из нее видно, что в 18 г воды, 44 г углекислого газа, 23 г Nа содержится столько же структурных единиц, сколько содержится в 12 г атома углерода.
Моль — мера количества вещества, в котором содержится столько структурных единиц, сколько атомов содержится в 12 граммах углерода.
При решении расчетных задач по химии удобно пользоваться этой единицей измерения. Допустим, вам нужно определить число молекул в два моль воды. Для этого составляется пропорция: первая часть - по определению, а вторая - по условию задачи.
1 моль Н2О : 6,02 • 1023 молекул = 2 моль Н2О : х молекул.
х = 12,04 • 1023 молекул.
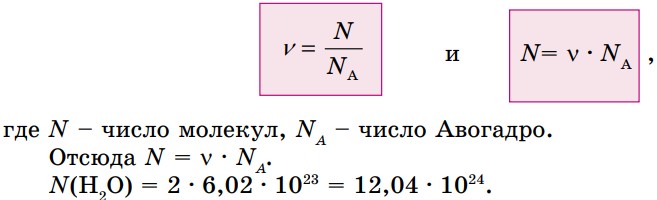
Моль, количество вещества, молярная масса, число Авогадро.
А
1. Дайте определение понятия «моль».
2. В чем различие между относительной молекулярной массой и молярной массой?
В
- Что означает число Авогадро?
- Рассчитайте массы сульфата меди (CuSO4), гидроксида натрия (NaOH), азота (N2), оксида фосфора (V), чтобы они содержали столько структурных единиц, сколько атомов содержится в 12 г углерода.
С
Расставьте коэффициенты в уравнениях. Определите количество вещества (в моль) участвующих и образующихся веществ. Определите типы реакций.
FeS + HCl → FeCl2 + H2S↑
Cu2O + O2 → CuO
HNO3 → NO2↑ + O2↑ + H2O
Al2O3 + H2SO4 → Al(SO4)3 + H2O
Pb(NO3)2 + KI → PbI2 + KNO3
§15. ВЗАИМОСВЯЗЬ МАССЫ, МОЛЯРНОЙ МАССЫ И КОЛИЧЕСТВА ВЕЩЕСТВА

С. Расчет числа структурных единиц.
Рассчитайте число структурных частиц, которое содержат 2 моль элемента водорода, 3 моль газообразного водорода, 5 моль серной кислоты.

В молекуле Н2SO4 содержатся 2 моль элемента Н, 1 моль элемента S и 4 моль элемента О, т. е. индексы в формулах веществ показывают число моль элементов в данном веществе.
D. Расчет молярной массы вещества.
Рассчитайте молярную массу вещества, если 1,204• 1024 молекул вещества весит 160 г.

А
- Определите число молекул в 50 г сахара (С12Н22О11).
- Рассчитайте массу воды количеством вещества 5 моль.
В
- Вычислите количество вещества и число молекул, содержащихся в 1 литре воды.
Ответ: 55,56 моль;
3,34 • 1025 молекул.
- Расположите эти вещества по уменьшению количества вещества, содержащегося в 40 г каждого из них. Выберите правильный ответ:
A. H2SO4
B. NaCl
1. ABCDE
2. EDCBA

ДЕЛАЕМ ВЫВОДЫ
- Моль - мера количества вещества, в котором содержится столько структурных единиц (атомов, молекул, ионов), сколько атомов содержится в 12 г углерода.
- В одном моль любого вещества содержится число Авогадро структурных единиц. NA = 6,02 • 1023 моль-1.
- Масса одного моль вещества называется молярной массой, обозначается буквой М. Молярная масса вещества (г/моль) численно равна относительно молекулярной массе.
