Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 12
Глава VII. ВОДОРОД. КИСЛОРОД И ОЗОН
§23. ВОДОРОД. ПОЛУЧЕНИЕ, ФИЗИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ
Вспомните: водород - элемент (Н), водород - простое вещество (Н2)
Общая характеристика водорода. Водород является первым элементом в Периодической системе Д. И. Менделеева. Химический знак элемента — Н (читается «аш»). Водород - неметалл, имеет 1 протон и 1 электрон. Электронная формула: 1s1, s-элемент. Относительная атомная масса Аг (Н) = 1,008, это самый легкий химический элемент. Водород в соединениях всегда одновалентен, он встречается в виде трех изотопов: 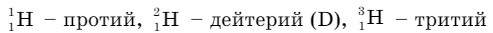 (Т) (рис. 21).
(Т) (рис. 21).
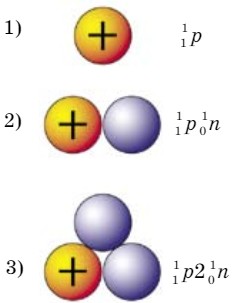
1 — протий; 2 - дейтерий;
3 — тритий
Открытие. Английский ученый Г. Кавендиш в 1766 г. получил водород действием цинка на растворы серной и соляной кислот. Ученый подробно исследовал свойства водорода, наблюдая его поведение на воздухе, и новому газу дал название «горючий воздух». А в 1783 г. французские ученые А. Лавуазье и Ж. Ме нье осуществили термическое разложение воды и установили, что вода состоит из кислорода и водорода.
Современное название водороду дал французский химик А. Титон де Морво в 1787 году. Он предложил название hydrogenium, означающее «рождающий воду». Тот же смысл заключается в казахском и русском названиях.

Физические свойства. Водород - простое вещество, состоит из двухатомных молекул Н2. Относительная молекулярная масса Мr(Н2) = 2, М (Н2) = 2 г/моль. Водород - бесцветный, без запаха, самый легкий газ из всех газообразных веществ при (н.у.) (р = 0,09 г/л). Температура кипения равна - 252,76°С, температура плавления равна - 259,2°С. Легче воздуха в 14,5 раз, малорастворим в воде. В 100 объемах воды при температуре 20°С растворяется 2 объема водорода.
Нахождение в природе. Водород - самый распространенный химический элемент во Вселенной, главная составная часть Солнца и большинства звезд. На Земле он находится только в связанном состоянии. В земной коре

на долю водорода приходится 92% от количества всех атомов. Его массовая доля составляет 1,4%, а в космосе — 63%. Он входит в состав воды, нефти, природного газа, каменного угля, а также в состав живых организмов. По распространенности на Земле водород занимает 9-е место. С применением водорода можете ознакомиться по рис. 22.
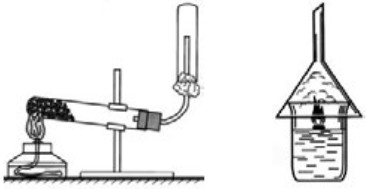
Получение в промышленности. В промышленности водород получают электролизом из самого распространенного вещества - воды (рис. 23); а также из углеводородов (метан).

Существуют и другие методы получения водорода для промышленных целей, вы будете изучать их позднее.
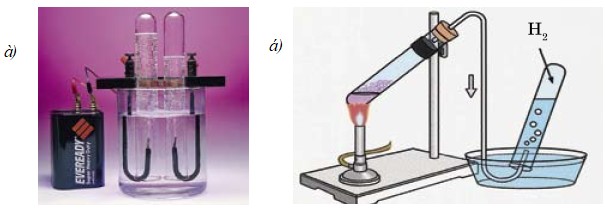
Получение в лаборатории.
В лабораторных условиях водород получают взаимодействием таких металлов как Fе, Zn, Мg и др. с растворами кислот. Обычно используют цинк и раствор соляной или серной кислоты (рис. 23).
Один и тот же металл вытесняет из разных кислот водород. Следовательно, можно сделать вывод: в состав кислот входят атомы водорода, которые замещаются на атомы металла.
металл + кислота = соль + водород
Для проведения вышеуказанной реакции в пробирку помещают 2-3 гранулы цинка. Через воронку наливают раствор соляной либо серной кислоты и закрывают пробирку пробкой с газоотводной трубкой. При этом протекают реакции замещения:
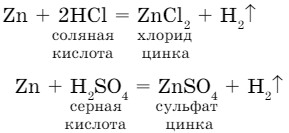
Полученный водород можно собрать двумя способами:
a) методом вытеснения воздуха в перевернутую вверх дном пробирку, так как водород легче воздуха в 14,5 раз.
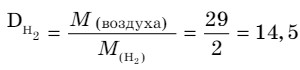
б) методом вытеснения воды, так как водород плохо растворим в воде. После того как пробирка наполнится газом, ее закрывают стеклянной пластинкой и подносят к горелке. Если водород чистый, без воздуха, то он сгорает спокойно, будет слышен лишь слабый хлопок. А если он загрязнен воздухом, то произойдет взрыв (безопасный). Этот способ называется проверкой водорода на чистоту.
Такие металлы, как литий, калий, натрий, кальций, барий могут вытеснить водород из воды (рис. 24).
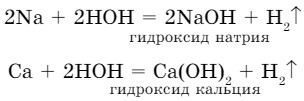
Реакции идут очень энергично, но эти металлы обычно не используются, так как это экономически невыгодно и небезопасно.
В химических лабораториях для многократного получения газов (Н2S, СО2), в том числе и водорода, используют прибор автоматического действия - аппарат Киппа (рис. 25). Это стеклянный прибор, состоящий из двух частей: шарообразного сосуда (1) с краном (5) и шарообразной воронки (2), конец которой на 1-2 см не доходит до дна сосуда.
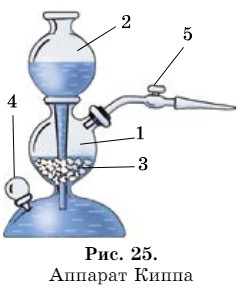
На дно стеклянного шара (1) помещают кусочки мрамора, металла и другие вещества. Боронка вставляется в сосуд герметично. Нижний полушар с краном (4) закрыт пробкой.
При зарядке аппарата для получения водорода в сосуд прибора через средний шар помещают твердое вещество (Zn). Затем закрывают пробкой с газоотводной трубкой (5) и при открытом кране (5) вливают в воронку раствор кислоты. Кислота поступает в нижнюю часть прибора, затем поднимается в средний шар, и начинается химическая реакция, выделяется газ. Как только кислота покроет твердое вещество, кран (5) закрывают. После этого кислота под давлением образовавшегося газа вытесняется в нижнюю часть прибора и в воронку, реакция прекращается. Аппарат начинает действовать при открытии крана (5).
Запомните! При опытах с водородом нельзя поджигать водород, не проверив его на чистоту, иначе внутри прибора может произойти взрыв. Это очень опасно!
Водород.
А
- Расскажите о распространении водорода в природе.
- Какие правила техники безопасности необходимо соблюдать при работе с водородом?
- Опишите принцип работы аппарата Киппа.
- Назовите лабораторные способы получения водорода, напишите уравнения соответствующих реакций.
- Напишите уравнения реакций магния с соляной и серной кислотами.
В
- Рассчитайте число молекул и количество вещества 50 г водорода.
Ответ: 1,5 • 1025 молекул; 25 молей.
2. Перепишите приведенные схемы уравнений реакций, вставив вместо вопросительного знака формулы соответствующих веществ, и расставьте коэффициенты.
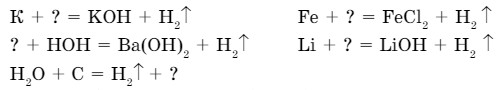
- Рассчитайте объем водорода (н. у.), который может выделиться при взаимодействии 11,2 г железа с соляной кислотой.
Ответ: 4,48 л.
- Какая масса водорода выделится при взаимодействии 7,8 г калия с водой?
Ответ: 0,2 г.
С
- Рассчитайте количество тепла, которое может выделиться при образовании 67,2 л (н. у.) водорода по термохимическому уравнению:
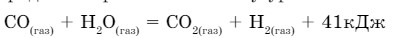
Ответ: 123 кДж.
- Сколько моль водорода образуется при взаимодействии 160 г железных опилок с соляной кислотой?
Ответ: 2,86 моль.
- Рассчитайте относительную плотность неизвестного газа по водороду, если его относительная плотность по воздуху составляет 2,21.
Ответ: 32.
§24 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
Взаимодействие водорода с простыми веществами. В обычных условиях водород (Н2) является устойчивым соединением.
1. При нагревании взаимодействует с некоторыми простыми веществами:
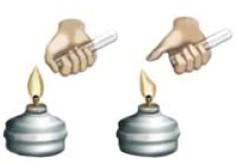
2Н2 + О2 = 2Н2О + 572 кДж
Для проведения этой реакции берут толстостенную пробирку, на стенках которой отмечены объемы, набирают 1 объем кислорода и 2 объема водорода и обертывают полотенцем для безопасности. При поднесении горящей лучинки к отверстию пробирки происходит взрыв. Водород активно взаимодействует с кислородом с выделением тепла (рис. 26). Взрыв происходит при V(Н2) : V(О2) = 2 : 1, поэтому смесь в таком соотношении газов называют гремучим газом.
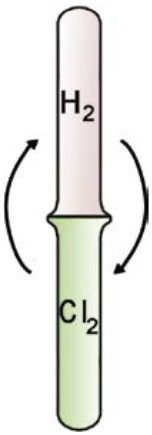
- При взаимодействии водорода с хлором образуется хлороводород с резким запахом, который раздражает слизистую оболочку дыхательных путей (рис. 27).
Н2 + Cl2 = 2HC1↑
- При пропускании через нагретую серу водород образует газ с неприятным запахом тухлых яиц - сероводород.
н2 + S → H2S↑
Соединениям водорода с неметаллами дают названия по следующему принципу: название неметалла + соединительная гласная о + слово «водород». Например:
HCl - хлороводород;
H2S - сероводород;
HF - фтороводород;
HBr - бромоводород.
Кроме того, некоторые соединения водорода имеют старинные (тривиальные) названия:
H2O — вода, NH3 - аммиак, CH4 - метан, SiH4 - силан и др.
- При взаимодействии водорода с металлами образуются твердые вещества - бинарные соединения, называемые гидридами.
H2 + 2Na = 2NaH - гидрид натрия;
H2 + Ca = CaH2 - гидрид кальция.
Названия соединений металлов с водородом: гидрид + название металла в родительном падеже. К примеру, A1H3 - гидрид алюминия.
Взаимодействие водорода со сложными веществами. При пропускании водорода через нагретый оксид меди (II) (порошок черного цвета) образуется порошок красного цвета (Cu) - металлическая медь:
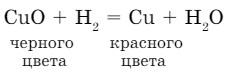
Водород — экологически чистое топливо, при его горении образуется природное соединение Н2О. Человечество заинтересовано в развитии водородной энергетики.
А
- Напишите известные вам уравнения реакций. На каких свойствах водорода основано его применение в этих процессах?
- Напишите уравнения реакций восстановления водородом оксидов вольфрама (VI) и свинца (II).
- Почему при получении металлов применяют водород?
- В каком из этих приборов можно собрать водород? Почему?
5. В двух герметично закрытых пробирках находятся водород и кислород. Как можно их обнаружить?
В
- Сколько граммов водорода потребуется для восстановления 44,6 г PbO? Ответ: 0,4 г Н2.
- Закончите уравнения следующих реакций:
HgO + H2 = Hg + ?; Mg + H2SO4 → MgSO4 + ?; Al + HCl → ? + ?.
- Какая масса водорода выделится при взаимодействии 5,4 г алюминия с соляной кислотой (HCl)? Сколько образуется воды при взаимодействии полученного водорода с кислородом?
Ответ: 0,6 г H2; 5,4 г H2O.
C
- Напишите уравнения реакций следующих превращений:
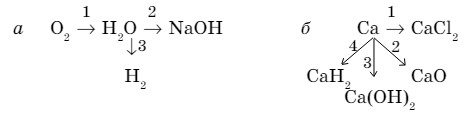
- Сколько граммов оксида меди (II) можно восстановить водородом, объем которого равен 4,48 л (н. у.)?
Ответ: 16 г.
- Сколько граммов водорода необходимо для восстановления 4 кг оксида меди (II)?
Ответ: 100 г Н2.
Практическая работа №2
Получение водорода и изучение его свойств
Цель: знать свойства водорода как восстановителя и уметь получить его.
| Реактивы | Химическая посуда и оборудование |
| Zn, H2SO4(1:5), Н2O, НС1 (разб.) | Штатив, пробирка, пробирка с газоотводной трубкой, спиртовка, спички, кристаллизатор |
- Соберите прибор, как показано на рисунке 23, б (с. 79), и проверьте его на герметичность.
- В пробирку поместите 3 гранулы цинка, через воронку налейте раствор соляной кислоты и плотно закройте пробкой с газоотводной трубкой.
- Водород соберите в перевернутую вверх дном пробирку методом вытеснения воды либо воздуха. Как только пробирка наполнится газом, закройте ее стеклянной пластинкой и поднесите к пламени спиртовки. Что при этом наблюдается?
Вопросы и задания.
- Почему водород собирают в перевернутую вверх дном пробирку?
- Напишите уравнение реакции получения водорода.
- Как практически определяют чистоту выделившегося водорода?
- Напишите уравнение реакции горения водорода на основе проведенного опыта.
ДЕЛАЕМ ВЫВОДЫ
- Водород — самый легкий элемент, имеет три изотопа: протий, дейтерий, тритий.
- По валентности (I) водорода определяют валентность других элементов.
- По водороду (Н2) определяют относительные плотности газов (DH2(Х)).
- Водород вступает во взаимодействие: а) со многими неметаллами, образуя летучие водородные соединения; б) химически активными металлами, образуя гидриды; в) с некоторыми оксидами.
