Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 13
§25.КИСЛОРОД. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ. ПОЛУЧЕНИЕ
Вспомните: кислород - элемент (О), кислород - простое вещество (О2), воздух

В виде простого вещества кислород входит в состав воздуха, что впервые установил в 1770 г. шведский химик К. Шееле. Объемное содержание кислорода в воздухе 21%. Эта величина (округлена до 20%) часто используется при решении задач. В земной коре в составе химических соединений содержится около 49% кислорода. Это видно из формул следующих природных соединений: Н2O — вода, SiO2 — песок, А12O3 • 2SiO2 • nН2O — глина, СаСO3 — мрамор и т. д. Кислород входит также в состав важнейших органических соединений живых организмов: белков, липидов, углеводов и др.
В Периодической таблице Д. И. Менделеева кислород находится на 8-м месте, химический знак — O (охуgеnium). Относительная атомная масса — 16. Кислород в соединениях проявляет валентность II.
Строение атома кислорода: +8) 2 ) 6, 1s22s22p4, р-элемент.
В воздухе содержится, кроме кислорода, азот - 78%; примерно 1% составляют инертные газы (гелий, неон, аргон и др.), что было установлено учеными в конце XIX века. Это постоянные компоненты воздуха. Есть и переменные компоненты - загрязняющие газы, состав которых зависит от местных условий (≈ 1%). К ним относятся углекислый газ и водяные пары. Таким образом, воздух является смесью газов.
М (O2) = 32 г/моль; М (N2) = 28 г/моль.
М (возд.) = 32 • 0,21 + 28 • 0,78 = 28,56 = 29 г/моль.
Массовая доля кислорода в воздухе — 23%. Запас кислорода в воздухе 1,5•1015 т, из них 1•1010 т расходуется на горение.
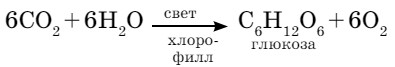
Количество кислорода в воздухе все время уменьшается под влиянием различных техногенных факторов, которые зависят от хозяйственной ориентации каждого конкретного региона. В то же время содержание кислорода в воздухе пополняется за счет процесса фотосинтеза, который идет непрерывно, поэтому состав воздуха остается примерно постоянным (рис. 28).
Экологическая обстановка в нашей республике, в первую очередь в промышленных городах, ухудшается из года в год (Усть-Каменогорск,
Павлодар, Тараз, Шымкент, Караганда, Текели и т. д.). Усиливает этот процесс и увеличение количества автомобилей.
До некоторого предела переменные компоненты воздуха не влияют на окружающую среду. Это количество называется предельно допустимой концентрацией (ПДК). Если содержание вредных примесей превышает ПДК, появляется опасность отравления и т. п. Организм человека чувствует снижение концентрации кислорода более чем на 1%.
Ученые всего мира упорно работают над созданием новейших экологически чистых технологий, ведь воздух определяет саму возможность жизни на Земле.
Вам уже знакомы реакции окисления — процессы взаимодействия простых и сложных веществ с кислородом.
Как химический элемент кислород образует два простых вещества: О2 — кислород и О3 — озон.
Из курса биологии вы уже знаете, что в процессе фотосинтеза растения поглощают углекислый газ и выделяют кислород, которым мы дышим. Растения являются «легкими» планеты. Поэтому не случайно в народе говорят: «Каждый должен вырастить хотя бы одно дерево». В последние годы в Казахстане по программе «Жасыл ел» ежегодно высаживают несколько сотен тысяч саженцев. Например, Астана окружена несколькими «зелеными поясами». Их площадь достигла 78 тыс. гектаров. Эти меры способствуют улучшению состава воздуха.
- Физические свойства.
Кислород О2 — бесцветный газ, без вкуса и запаха, температура кипения - 183°С, плотность 1,43 г/л, тяжелее воздуха. Малорастворим в воде: в 1 л воды при нормальных условиях растворяется 0,04 г кислорода (табл. 9).
Таблица 9. Сравнительная характеристика физических свойств водорода и кислорода

ПОЛУЧЕНИЕ КИСЛОРОДА
Промышленный способ получения кислорода заключается в сжижении воздуха при низких температурах и его перегонке. Вначале из жидкого воздуха отгоняют газообразный азот (его температура кипения ниже, чем у кислорода). В жидком состоянии остается почти чистый кислород. Его хранят в баллонах голубого цвета, так как жидкий кислород имеет светлоголубой цвет (рис. 29).
Лабораторные способы получения кислорода основаны на реакциях разложения некоторых богатых кислородом веществ.
- Разложение перманганата калия.
В сухую пробирку насыпаем немного вещества и, закрыв пробирку пробкой с газоотводной трубкой, осторожно нагреваем. При этом протекает химическая реакция:
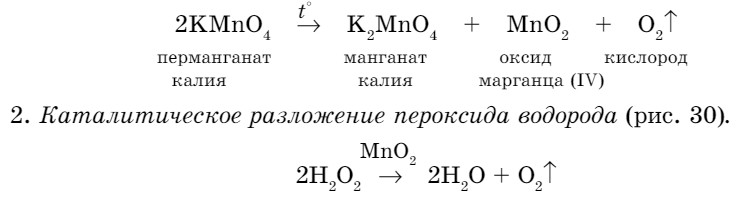

Тлеющей лучинкой проверяем наполненность пробирки кислородом. Если ее поднести к отверстию трубки, она вспыхнет.
- Каталитическое разложение хлората калия.
Для ускорения этой реакции добавляем к хлорату немного оксида марганца (IV) и нагреваем. Вещества, ускоряющие реакцию и при этом не расходующиеся, называются катализаторами.
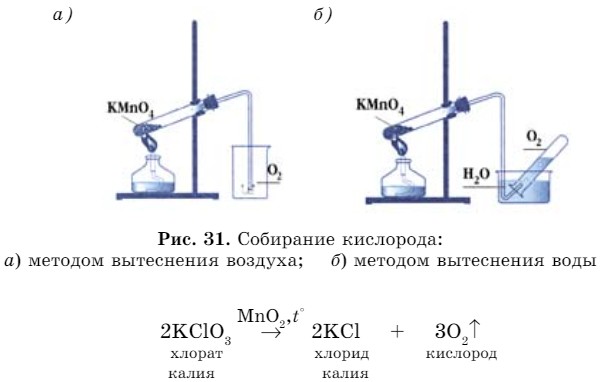
Выделившийся кислород можно собрать двумя способами:
- вытеснением воздуха, так как кислород тяжелее (рис. 31, а):
- вытеснением воды, т. к. он плохо растворяется в воде (рис. 31, б).
Мr (О2) = 32 Мr (возд.) = 29.

В 1774 г. английский ученый Д. Пристли получил кислород разложением оксида ртути (II):
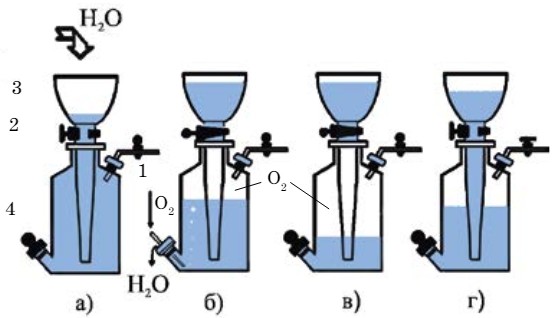
Для хранения газов в лабораториях используют газометр (рис. 32). Газометр состоит из сосуда и большой воронки, конец которой немного не доходит до дна сосуда. Воронка, снабженная краном, вставляется в сосуд на шлифе, обеспечивающем герметичность прибора. Перед наполнением газометра газом воздух из него вытесняют водой. Для этого открывают краны 1 и 2. Через воронку 3 вливают воду и доверху заполняют ею газометр. Затем закрывают оба крана,
вынимают пробку из тубуса 4 и вводят в газометр конец газоотводной трубки от прибора для получения газа. Газ поступает в газометр, вытесняя из него воду, которая выливается в стеклянную ванну или раковину. После наполнения газометра газом закрывают нижнее отверстие 4 пробкой и наливают воду в воронку 3. Для выпуска газа из газометра открывают кран 1 и слегка — кран 2. При этом вода из воронки поступает в сосуд и вытесняет из него газ, который выходит через газоотводную трубку и может быть направлен в сосуд-приемник.
В газометре можно хранить газы, малорастворимые в воде и не взаимодействующие с ней. Взрывоопасные газы нельзя хранить в газометре.
- Рассчитайте массовую долю кислорода в следующих соединениях: Н2О, КМnО4, КСlО3, Н2О2, НgО.
- Расставьте коэффициенты в приведенных уравнениях реакций и укажите, к какому типу относится каждая из них: Н2О → Н2↑ + О2↑ Мg + О2 → МgО Н2О2 → Н2О + О2
- Определите валентность элементов в оксидах: РbО2, SnО, В2О3, SiO2, Li2О, Сl2О7, СrО3.
- Какие вещества называются катализаторами?
В
- Определите массовую долю кислорода в следующих веществах: Аl2О3, Сr2О3, Fе2О3, В2О3.
- Какое из этих соединений богаче кислородом?
- В какой массе оксида фосфора (Р2О5) содержится 9,3 г фосфора?
Ответ: 21,3 г.
- Рассчитайте массы соединений, содержащих 0,5 моль кислорода: Аl2О3, Н2SiO3, NаОН, Nа2SO4.
- Составьте эссе на тему «Применение кислорода» по рис. 29.
С
- Сколько граммов хлората калия (КС1О3) необходимо для получения 0,672 л кислорода (н.у.)?
Ответ: 2,45 г.
- Вычислите массу воды, образовавшейся при взаимодействии 40 г СuО с водородом.
Ответ: 9 г.
- Определите формулы веществ, если массовые отношения элементов в них таковы:
т (Р) : т (О) = 31 : 40
т (Nа) : т (С) : т (О) = 23 : 6 : 24
т (Н) : т (N) : т (О) = 1 : 14 : 48
- Какой объем кислорода (н.у.) образуется при разложении перманганата калия массой 4,74 г?
Ответ: 0,336 л.
5. Сравните свойства кислорода и водорода, используя таблицу 9.
Демонстрация №4
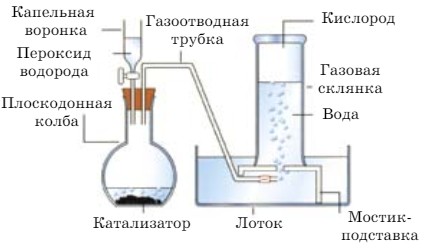
Разложение пероксида водорода
Опыт проводит учитель, учащиеся наблюдают, делают выводы.
Цель: Уметь получать кислород и собирать двумя способами.
| Реактивы | Оборудование |
| Н2О2 — пероксид водорода (3%-ный раствор), МnО2 — оксид марганца (IV) | Штатив, пробирки, цилиндр, кристаллизатор, лучинка, стеклянная пластинка, спички, пробка, спиртовка, термостойкий стакан. |
- Закрепите вертикально в зажиме штатива термостойкую пробирку.
- В пробирку наберите немного раствора пероксида водорода и всыпьте в пробирку заранее приготовленного порошка диоксида марганца.
- Опустите в пробирку тлеющую лучинку. Затем пробирку закройте пробкой с газоотводной трубкой. Опыт можно провести в термостойком стакане (рис. 33).

Что происходит?
Собирание выделяющегося газа
Цилиндр, предназначенный для собирания газа, предварительно заполните водой, закройте стеклянной пластинкой и пробкой, опустите вниз отверстием в кристаллизатор, в который налита вода и откройте отверстие цилиндра (рис. 30).
Проверьте наполненность сосудов кислородом.
Вопросы и задания.
- По каким признакам вы судите о прохождении реакции?
- На каких свойствах кислорода основаны способы его собирания?
- Какую роль играет диоксид марганца?
- Напишите уравнение реакции.
§26. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Химические свойства. При нагревании кислород взаимодействует со многими веществами.
Этот процесс называется горением и сопровождается выделением тепла и света.
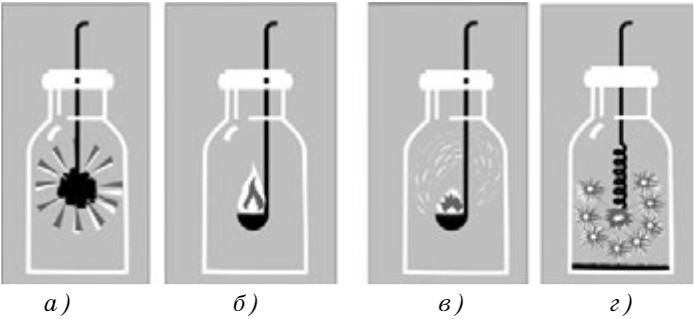
Взаимодействие с простыми веществами. Если бросить кусочек тлеющего угля в пробирку с кислородом, то он раскаляется и сгорает (рис. 34, а).

Фосфор горит очень интенсивно (рис. 35). За считанные секунды колба наполняется белым дымом, на стенках колбы оседает оксид фосфора (V).


Некоторые металлы также взаимодействуют с кислородом с образованием оксидов. Держа щипцами зажженную ленту магния, поместим ее в сосуд с кислородом. Магний горит светящимся пламенем. (Нельзя долго смотреть на горящий магний, это вредно для глаз.)
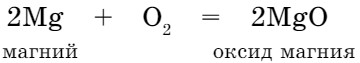
Раскаленный уголек поместим на кончике железной проволоки, прикрепленной к лучинке, и опустим в пробирку с кислородом. При этом загорятся и лучинка, и уголь, и даже железо (рис. 36):
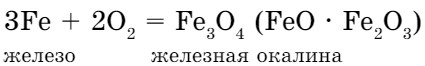
Горение железа сопровождается треском и «фейерверком» искр - расплавленных капель железной окалины.
При взаимодействии простых веществ - металлов и неметаллов - с кислородом образуются оксиды.
Оксидами называются сложные вещества, состоящие из атомов двух элементов, один из которых кислород. Химические реакции между кислородом и другими веществами называются реакциями окисления.
Названия оксидов образуются с помощью слова «оксид» и соответствующего названия элемента с указанием в скобках переменной валентности. Например, SО2 — оксид серы (IV), SО3 - оксид серы (VI). По международной номенклатуре в названии оксида греческими числительными указывается количество атомов элементов. Например, CO - монооксид углерода, СО2 - диоксид углерода, МnО2 - диоксид марганца, Мп2О7 - гептаоксид димарганца.
Взаимодействие со сложными веществами. Некоторые сложные вещества также взаимодействуют с кислородом с образованием оксидов. Например, при горении пропана, который входит в состав природного газа, протекает следующая реакция:
В металлургии в обжиговых печах протекают реакции окисления обогащенных руд:
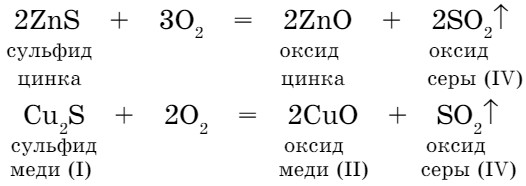
Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.
Таблица 10. Сравнительная характеристика химических свойств кислорода и водорода

А
- Назовите признаки реакции горения.
- Можно ли «переливать» кислород из одного сосуда в другой?
- Объясните принцип работы газометра.
- На каких свойствах кислорода основаны способы его собирания?
В
- Дайте названия по международной номенклатуре следующих оксидов: SnО, SnO2, SO2, SO3, СrО, Сr2O3, РbО, РЬО2.
- Во сколько раз молекула озона тяжелее кислорода и водорода?
- Вычислите массовую долю кислорода в составе песка (SiO2).
- Сравните химические свойства кислорода и водорода, используя таблицу 10.
С
Закончите уравнения реакций и расставьте коэффициенты:

Как называются реакции с участием кислорода? Чем является кислород: окислителем или восстановителем?
- Определите массу и количество вещества кислорода, который выделится при разложении 24,5 г хлората калия КСlО3.
Ответ: 9,6 г; 0,3 моль.
Одинаковы ли будут массы кислорода, образовавшегося при разложении 5 моль следующих веществ: КСlО3, КМnО4, Н2О2, НgО? Ответ подтвердите расчетами.
