Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 2
§3 ОБРАЗОВАНИЕ ИОНОВ
Вспомните! Строение атома, завершенный слои, электронная конфигурация элемента
После ознакомления с электронным строением атомов можно приступить к изучению способности элементов образовывать химические соединения.
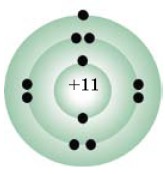
Каждый период в системе заканчивается инертным газом. Как вы думаете, почему они так инертны? Для выяснения этого вопроса рассмотрим электронные структуры этих элементов. Нам известно строение атомов 2 He(1 s2), 20 Ne (1s 22s 22p 6),  (1 s 22 s 22p 63s 23p 6). У всех этих газов внешние энергетические слои завершены, у гелия 2 e , у остальных по 8 * электронов (рис. 6).
(1 s 22 s 22p 63s 23p 6). У всех этих газов внешние энергетические слои завершены, у гелия 2 e , у остальных по 8 * электронов (рис. 6).
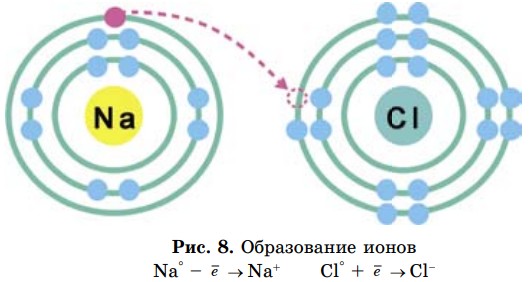
У других элементов химическая активность определяется именно этой недостроенностью внешнего электронного слоя. Они могут завершить внешние электронные слои путем отдачи или присоединения электронов при образовании соединений (рис. 7).

Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу, которые называются ионами, т. е. имеют завершенный энергетический уровень.
А это зависит от двух факторов:
- от электронного строения атомов;
- от радиуса атомов.
Заряды ионов пишутся арабскими цифрами сверху над символом элемента, знак заряда указывается после числового значения: например: S2-, Cl-, H+, Ca2+.
У элементов, расположенных в начале периодов, на внешней орбитали электронов мало (1-3). Поэтому они легко отдают эти электроны, принимая при этом электронное строение инертного газа, которым заканчивается предыдущий период. А у элементов, расположенных в конце периодов, число электронов на внешнем уровне больше, поэтому они легко принимают электроны. При этом они принимают конфигурацию инертного газа, которым заканчивается данный период. По периодам число электронов на внешнем электронном уровне (валентные электроны) постепенно увеличивается. Слева направо увеличиваются заряды ядер атомов. То есть в этом направлении усиливается способность принимать электрон.
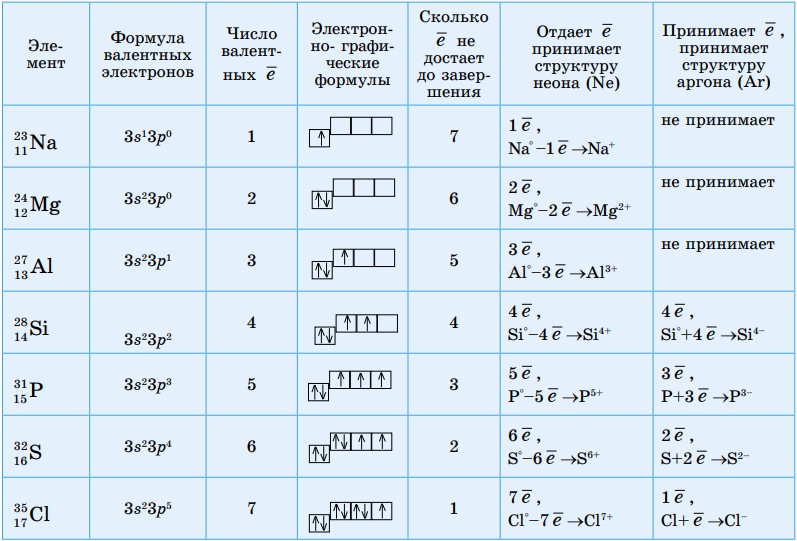
Напишем формулы валентных электронов элементов III периода. Определим число неспаренных электронов и число электронов, недостающих до завершения энергетического уровня (табл.4).
Таблица 4. Возможности завершения энергетического уровня элементов III периода
Рассмотрим, как заряжаются атомы элементов при образовании соединения с изменением их электронных структур.

Для завершения внешнего слоя атому хлора недостает лишь одного электрона, поэтому он принимает один электрон от атома магния, превращаясь при этом в отрицательно заряженный ион.
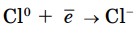
А у атома магния на внешнем слое имеются два электрона, он отдает каждому атому хлора по одному электрону, т. е. требуется два атома хлора.

Как изменяются эти свойства по группам? Число валентных электронов одинаковое у элементов, расположенных в одной группе. А число электронных слоев, т. е. атомных радиусов в этом направлении, увеличивается. По этой причине усиливается способность отдать электрон e внешнего уровня.
Способность элемента отдать электрон характеризует металлические, а принимать — неметаллические свойства.
Для выяснения этого вопроса рассмотрим электронное строение и значения атомных радиусов элементов IA и VIIA групп (табл. 5).
Таблица 5. Атомные радиусы атомов IA и VIIA групп

- По периодам слева направо металлические свойства ослабевают, неметаллические свойства постепенно усиливаются;
- По группам сверху вниз усиливаются металлические свойства.
Ионы, условия образования положительно и отрицательно заряженных ионов.
А
- Как образуются ионы?
- Чем отличаются ионы от атомов и молекул?
- Ионы каких элементов заряжены положительно?
В
- Как меняются радиусы атомов слева направо (по периоду)?
- Как меняются металлические свойства по периодам?
- Сравните значения радиусов атомов элементов металлов и неметаллов, расположенных в одном периоде.
С
- Сколько электронов, протонов и нейтронов в ионах: Na+, Al3+, Mg2+?
- Допишите электронные переходы в следующих превращениях:

3. Определите заряды ионов, которые образуются в результате следующих превращений:

