Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 3
§4. СОСТАВЛЕНИЕ ФОРМУЛ СОЕДИНЕНИЙ
По пройденным материалам вы знаете, что атомы являются электроней- тральными частицами. Потому что количество электронов, которые вращаются вокруг ядра, численно равно заряду ядра, точно так же, абсолютные значения положительно и отрицательно заряженных частиц, составляющих молекулу, будут равны. Поэтому и молекула электронейтральна.
Теперь попытаемся составить формулу обыкновенной поваренной соли. В состав этого вещества входят элементы натрий и хлор в виде ионов. А образование этих ионов вам знакомо из предыдущего параграфа. Теперь обратим внимание на числовые значения зарядов данных ионов:
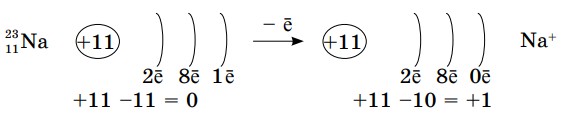
При образовании иона натрия заряд ядра превышает на единицу общее количество электронов, которые вращаются вокруг ядра.
А при образовании ионов хлора, наоборот, общее количество электронов становится больше на единицу, чем заряд ядра.
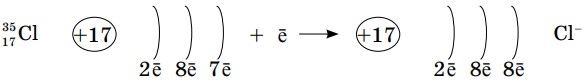
При написании формул бинарных (состоящих из двух элементов) соединений мы должны придерживаться такого правила:
B молекулах бинарных соединений положительно заряженная частица пишется (в основном) на первом месте, отрицательная — на втором.
B соединениях, состоящих из элементов металла и неметалла, частицы атомов металла всегда положительно заряжены, а неметаллы — отрицательно.
Тогда формула поваренной соли выглядит так: NaCl (хлорид натрия).
B название бинарных соединений к международному или сокращенному названию элемента добавляется окончание ид, Na2S — сульфид натрия, SiO2 — оксид кремния (IV), Si3N4 — нитрид кремния (IV).
Далее рассмотрим составление формулы хлорида магния:
+2 -1
Mg Clх
Используя правило «нулевой суммы», составим такое уравнение:
+2 + (—1) х = 0 => х = 2, следовательно, формула вещества: MgCl2.
I. Рассмотрим примеры составления формул и определения зарядов элементов соединений по этому способу.
Пример 1. Составьте формулу оксида трехвалентного элемента.
Напишем схему формулы оксида трехвалентного элемента — 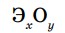

- Как меняются неметаллические свойства элементов с начала к концу периода?
- Как меняются значения радиусов атомов и металлические свойства сверху вниз по группам?
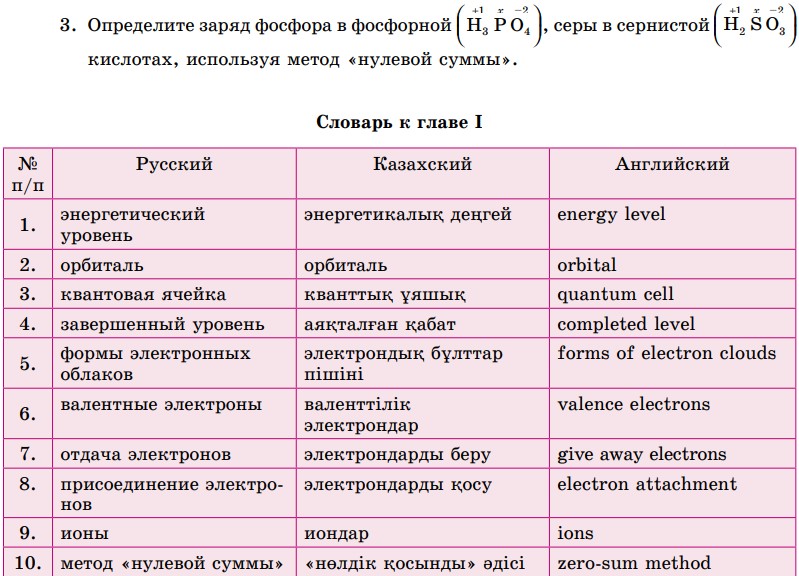
- На чем основан метод составления формул «нулевой суммы»?
В
- Укажите заряды в соединениях: KCl, MgO, NaCl, MgCl2.
- Составьте формулу соединения, если заряд алюминия +3, углерода -4.
- Объясните образование молекулы иодида калия путем отдачи и приема электронов атомами элементов.
С
- Напишите формулы кислородных соединений данных элементов: Ca, C, S, N, P, Cl, если заряд кислорода в них -2.
- Определите заряды атомов элементов в соединениях: MgCl2, BaI2, Na2S, ZnO, Cu2O, CuO, CaCl2, если заряды хлора, иода - 1; серы, кислорода -2.
ДЕЛАЕМ ВЫВОДЫ
- Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни.
- Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью. Формы s-облаков — сферическая, а р-облаков — гантелеобразная.
- Изображение электронов в атоме с помощью электронных облаков и распределение по уровням и подуровням называется электроннографической формулой.
- Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу. Эти заряженные частицы называются ионами.
- Алгебраическая сумма зарядов элементов в соединении равна нулю.
Глава II. ФОРМУЛЫ ВЕЩЕСТВ И УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
§5 РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ
По химическим формулам веществ можно производить различные расчеты:
1. Определение численного соотношения атомов.
Для молекулы SO3 численное соотношение атомов составляет 1 : 3, а для H3PO4 - 3 : 1 : 4.
2. Определение относительной молекулярной массы вещества.
M r (H2SO4) = 2А r (H) + A r(S) + 4A r (O);
M r (H2SO4) = 2 • 1 + 32 + 4 • 16 = 98.
3. Расчет массы одной молекулы вещества.
Для молекулы SO3:
m M(SO3) = M r (SO3) • 1,66 • 10-27;
m M(SO3) = 80 • 1,66 • 10-27 = 1,33 • 10-27 кг.
4. Определение массовых отношений химических элементов в сложном веществе.
Для молекулы SO2 вначале записываем значения атомных масс:
Ar (O) = 16; Ar (S) = 32
m (S) : m (O) = 32 : (16 • 2) = 1 : 1.
5. Расчет массы элемента по известной массе вещества и обратная задача.
а) Сколько граммов меди содержится в 320 г оксида меди (II)?


6. Расчет массовой доли химического элемента в сложном веществе.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (w) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:


Если вещество состоит из трех элементов, для определения массовой доли третьего элемента можно определить массовые доли двух элементов, затем их сумму отнять от 100%.
6. Составление формул по соотношению масс и массовых долей элементов в молекуле.
а) Выведите формулу вещества, если соотношение масс элементов m (S) : m (о) = 2 : 3.

6. Определение соотношения чисел атомов элементов.
Поскольку в молекулах не может быть дробных чисел атомов, то делением на наименьшее значение или умножением на какое-то число превращаем дробные числа в целое число:


А
1. Определить массовые соотношения атомов элементов в сульфате меди (II) (CUSO4).
Ответ: m(Cu) : m(S) : m(O) = 2 : 1 : 2
- Составьте формулы кислородных соединений фосфора, если известно, что соотношения чисел атомов в них 2 : 3 и 2 : 5.
- Составьте формулы кислородных соединений углерода, зная, что соотношения чисел атомов в них 1 : 2 и 1 : 1.
- Соотношения чисел атомов элементов следующие:
(С) : (Н) = 1 : 4; (С) : (Н) = 3 : 8; (Н) : (S) = 2 : 1;
Составьте формулы водородных соединений.
В
- Рассчитайте массовые доли атомов элементов в оксиде меди (II) CuO.
- Рассчитайте массовые доли элементов соединения ZnSO4 - сульфата цинка.
Ответ: w(Zn) = 0,404; w(S) = 0,199;
w(O) = 0,397.
- Составьте формулу нитрата серебра (I) по массовым долям элементов: w(Ag) = 63,53%; w(N) = 8,23%; w(O) = 28,24%
- Какова формула вещества, если массовые соотношения элементов таковы: m (H) : m (S) : m (O) = 1 : 16 : 24?
C
- Расположите формулы соединений по возрастанию массовой доли фосфора. Выберите правильный ответ.