Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 9
Глава V. СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ
§16. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
Вспомните! Уравнения химических реакций. Закон сохранения массы вещества. Составление и решение пропорции.
По уравнениям химических реакций можно решать множество количественных задач. Мы остановимся на расчетных задачах по нахождению массы (т) и числа молей (v) продуктов реакции по известной массе участвующих в реакции веществ.
Решение задач осуществляется по следующему алгоритму:
- Внимательно прочитать и коротко записать условие задачи.
- Составить уравнение соответствующей химической реакции.
- В соответствии с коэффициентами вычислить количество (v), молярную массу (М), массу (т) веществ и записать эти данные под формулами этих веществ в уравнении.
- Данные по условию задачи и искомые величины (х) записать над формулами этих веществ.
- Составить пропорцию и найти неизвестную величину (х).
- Записать ответ.
Задача 1. Сколько граммов хлорида натрия образуется при взаимодействии 92 г натрия с хлором?

Задача 2. Сколько молей углекислого газа образуется при горении 36 г углерода?





§17. ЗАКОН АВОГАДРО. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ
Многие химические вещества существуют в газообразном состоянии, например H2, N2, O2, Cl2 и др. Встречаются также сложные газообразные вещества: метан CH4, углекислый газ CO2, сернистый газ SO2, хлороводород HCl, сероводород H2S и др. Газообразные вещества подчиняются физическим законам, о которых вы знаете из курса физики. Состояние газообразных веществ характеризуется температурой, давлением и объемом.
Объем газов зависит от температуры и давления. При постоянном давлении и температуре расстояния между молекулами газообразных веществ примерно одинаковы.
Из курса физики вам известно понятие «плотность» (p).

В таблице 8 приведены некоторые величины, характеризующие известные вам газы.
Таблица 8. Количественные характеристики некоторых газов
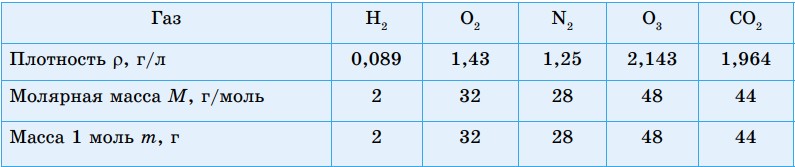
Рассчитаем объем 1 моля каждого газа (при н.у.):
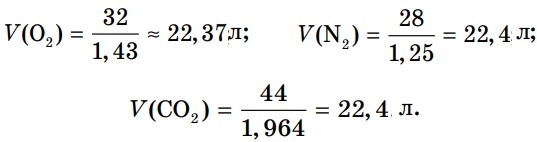
Как видно из этих расчетов, объемы одного моля различных газов при нормальных условиях (н. у.), т. е. при температуре 0°С и давлении 1 атм (101,3 кПа), примерно одинаковы и составляют 22,4 л. При стандартных условиях (t = 25°С, р = 101,3 кПа) молярный объем составляет 24 л. Эта величина называется молярным объемом и обозначается Vm (рис. 20). Молярным объемом газов (Vm) называют отношение объема газа (V) при н. у. к количеству вещества (v).
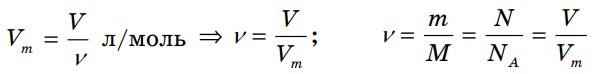
В 1 моль любых веществ, в том числе и газах, содержится одинаковое число молекул, которое называется числом Авогадро (NA). NA = 6,02 • 1023 моль-1.
В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. Этот закон был сформулирован итальянским ученым Авогадро в 1811 году.
Плотностью газа при н. у. называется отношение молярной массы газа на молярный объем.
Плотность газа при нормальных условиях:
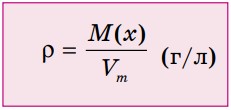
- Доказательство закона Авогадро.
Найдите число молекул и массы кислорода и углекислого газа объемом 50 л, взятых при нормальных условиях (н. у.).


- Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи.
- Определите объем, число молекул, количество вещества 8,8 г углекислого газа при н. у.

б) Рассчитайте массу, количество вещества и число молекул 67,2 л кислорода при н. у.

в) Рассчитать объем, массу, число молекул в 0,5 моль аммиака (н. у.).

г) Определите объем (н. у), массу и количество вещества сернистого газа числом молекул 2,408 • 1024.

Нормальные и стандартные условия, молярный объем, число и закон Авогадро.
А
- Каково значение молярного объема при н. у.?
- В чем различие нормальных и стандартных условий?
- Сформулируйте закон Авогадро.
В
- Рассчитайте число молекул водорода, кислорода и углекислого газа объемом 1 л (н. у.).
- Рассчитайте плотность следующих газов (н. у.): аммиака NH3, хлора С12, метана СН4, сернистого газа 802, водорода Н2.
- Рассчитайте молярную массу газа, если масса одного литра (н. у.) 1,339 г.
- Рассчитайте объем водорода (н. у.), выделившегося при взаимодействии 2,34 г калия с водой.
Ответ: 0,672 л.
С
- Найдите объем (н. у.), массу, число молекул 0,5 моль углекислого газа.
Ответ: 22 г, 3,01 • 1023, 11,2 л
- Рассчитайте массу, количество вещества, число молекул 89,6 л хлора Сl2 и кислорода при нормальных условиях.
Ответ: 2,408 • 1024, 284 г Сl2, 128 г О2; 4 моль.
- Определите объем (н. у.), количество вещества и число молекул 128 г оксида серы (IV).
Ответ: 2 моль; 44,8 л; 1,204 • 1024.
- Найдите объем (н. у.), массу и количество вещества 3,1 • 1024 молекул метана СН4.
Ответ: 112 л, 80 г, 5 моль.
- Рассчитайте массу 0,5 моль неизвестного газа, если 1 л этого газа при н. у. весит 1,964 г.
Ответ: 22 г.
