Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 14
§27 | ОЗОН
Кислород в природе встречается в виде двух простых веществ: кислорода О2 и озона О3 (от греческого озон - «пахнущий»). Озон образуется во время грозы при электрическом разряде из атмосферного кислорода (табл. 11). Превращение кислорода в озон выражается следующим уравнением реакции:
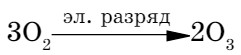
Таблица 11. Сравнительная характеристика кислорода и озона
| Кислород (О2) | Озон (О3) |
| Газ без запаха и цвета, чуть тяжелее воздуха. Плохо растворим в воде (при 20°С в 100 объемах воды растворяется 3 объема, а при 0°С - 5 объемов кислорода). Участвует в процессах дыхания, горения, окисления и гниения. | Газ с характерным запахом свежести, голубоватого цвета, плохо растворим в воде, тяжелее воздуха в 1,655, а кислорода - в 1,5 раза. Озон - химически активное вещество, обладает бактерицидными и отбеливающими свойствами, |
| что объясняется выделением атомарного кислорода при реакции: О3 ↔ О2 + О. При концентрации 10-5% становится ядовитым. |
Явление образования нескольких простых веществ одним элементом называется аллотропией (рис. 37). Разные простые вещества, образованные одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).

Формула озона О3, относительная молекулярная масса 48, температура кипения - 112°С, температура плавления — 193°С, в жидком состоянии цвет темно-синий, а в твердом - от синего до темно-фиолетового. Этот газ был впервые обнаружен голландским химиком Мартином фон Меррумом (1785).
Химические свойства озона.
Озон химически более активен, чем кислород, и может окислять благородные металлы: золото, серебро, платину:
6Ag + О3 = 3Ag2О
Активность озона обусловлена его разложением на молекулярный и атомарный кислород:
О3 → О2 + О
Этим же объясняется свежесть воздуха после грозы в сосновом бору. Атомарный кислород - более сильный окислитель, чем молекулярный. Данное свойство применяется при обеззараживании питьевой воды и при отбеливании ткани, бумаги, соломы и т. д. Применение озона при обеззараживании вместо хлора экологически более выгодно. Озон, окисляя примеси сточных вод, превращается в кислород.
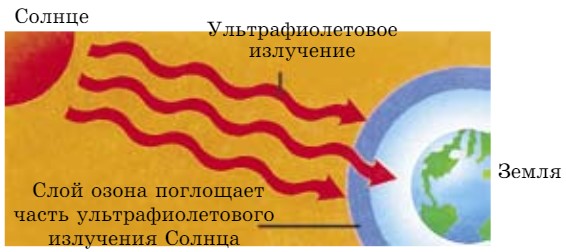
В верхних слоях атмосферы на высоте 25 км над землей (в стратосфере) образуется тонкий слой озона, который защищает Землю от чрезмерной дозы ультрафиолетовых лучей (УФО) Солнца (рис. 38). Этот слой разрушается под воздействием различных факторов («озоновые дыры»). Например, при запуске ракетоносителя космического корабля, а также двигатели самолетов выбрасывают в верхние слои атмосферы определенную массу оксидов азота (II).
Оксид азота (II) вступает в реакцию с озоном:
NO + О3 = NO2 + О2
Это приводит к всевозможным природным катаклизмам (глобальное потепление, таяние ледников и айсбергов, цунами, тайфуны, сели, торнадо и т. д.).
А
- Приведите примеры процессов, происходящих с участием кислорода (горение, гниение, брожение).
- Назовите источники загрязнения атмосферного воздуха в вашем регионе.
- Обоснуйте необходимость «зеленых поясов» вокруг больших городов и крупных промышленных заводов.
В
- Напишите уравнения реакций, с помощью которых получают кислород в лаборатории.
- Напишите формулы оксидов следующих элементов: Р(III, V), N(II, IV), С1(I, III, V, VII).
- Рассчитайте относительную плотность озона по воздуху и по водороду.
С
- Кислород составляет 65% массы вашего тела. Рассчитайте массу кислорода в вашем организме.
- Каким веществом - кислородом или озоном - быстрее окисляется благородный металл серебро? Почему?
Практическая работа №3
Получение кислорода и изучение его свойств
Цель: учащиеся самостоятельно проводят работу, изучают свойства кислорода. Знать свойства кислорода как окислителя.
| Реагенты | Оборудование, посуда |
| Пероксид водорода, диоксид марганца (МnО2) - катализатор, лента магния, сера, индикаторы: метилоранж, фенолфталеин; вода. | Большие пробирки или стаканы, спиртовки, спички, лучинка, штатив, пробка с газоотводной трубкой. Склянки или большие пробирки для собирания газа - кислорода, железная ложка, железные щипцы. |
Ход работы
- Соберите прибор по рис. 30 (с. 88).
- В колбу наберите немного раствора пероксида водорода с помощью капельной воронки.
- Всыпьте в колбу заранее приготовленный диоксид марганца. Затем колбу закройте пробкой с газоотводной трубкой. Что наблюдаете?
- Соберите выделившийся кислород в большие пробирки.
- В железную ложку положите небольшой кусочек серы, зажгите его в пламени спиртовки и внесите в сосуд с кислородом, постепенно опуская ложечку.
- После сжигания серы влейте в сосуд немного воды, закройте сосуд и хорошо взболтайте, затем подействуйте индикатором - метилоранжем.
Вопросы и задания.
- Напишите уравнения реакций. Определите типы реакций.
- Назовите признаки протекания реакций.
- Как доказана природа продуктов реакций? Дать обоснованный ответ.
Словарь по темам «Топливо», «Водород, кислород, озон»
ДЕЛАЕМ ВЫВОДЫ
- Кислород — самый распространенный в природе элемент. Он встречается в виде двух аллотропных модификаций: кислород (О2) и озон (О3).
- С участием кислорода идут процессы медленного окисления, горения, гниения, брожения.
- Явление образования нескольких простых веществ одним элементом называется аллотропией.
- Кислород вступает в реакцию с металлами, неметаллами и сложными веществами.
Глава VIII. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
§28. СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ

Ядро, электроны, электронная формула
Периодическая система Д. И. Менделеева состоит из семи периодов. Обозначаются они арабскими цифрами.
Периодами называются горизонтальные ряды элементов, расположенные по возрастанию их атомных масс. Начинаются периоды со щелочных металлов и заканчиваются инертными газами.
В соответствии с современными научными представлениями о структуре атома Периодический закон формулируется так:
Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда их атомных ядер.
Почти все элементы за исключением некоторых в Периодической системе
пронумерованы в порядке возрастания их относительных атомных масс, т. е. каждый элемент имеет свой порядковый номер. Его физический смысл — заряд ядра атомов элементов. Периоды подразделяются на малые (1-3), которые состоят из одного ряда, и большие (4-7), состоящие из двух рядов. Седьмой период не завершен.
Вертикальные ряды элементов называются группами. Обозначаются они римскими цифрами. В Периодической системе восемь групп, каждая из них состоит из двух подгрупп: главной и побочной. В главную подгруппу входят элементы как малых, так и больших периодов, а в побочную подгруппу - только элементы больших периодов.
Например, в главную подгруппу IV группы входят углерод (С), кремний (Si), германий (Gе), олово (Sn), свинец (Рb), а в побочную - титан (Тi), цирконий (Zr), гафний (Hf).
Группами называются вертикальные ряды элементов, сходных по свойствам и расположенных по возрастанию атомных масс.
Подытоживая эти особенности, Д. И. Менделеев выдвинул следующие предположения:
- Периоды могут быть разной длины.
- Некоторые химические элементы еще не открыты (для них он оставил пустые места).
Главная и побочная группы. Периоды большие, малые.
А
1. Найдите в Периодической системе те пары элементов, расположение которых не соответствует возрастанию их атомных масс.
2. Формула водородного соединения элемента III периода Н2Э. Определите относительную молекулярную массу этого соединения.
В
- Составьте формулу оксида элемента III периода III группы главной подгруппы, рассчитайте массовую долю элемента. Напишите электронную и электронно-графическую формулу элемента.
- Составьте формулы оксида и водородного соединения элемента II периода IV А подгруппы. Рассчитайте отношение масс элементов в соединениях. Напишите электронную и электронно-графическую формулу элемента.
- Определите место расположения элемента в периодической системе элементов, если относительная молекулярная масса оксида Э2О3 равна 70.
С
- Массовое отношение в оксиде элемента II(А) группы - 3 : 2. Определите этот элемент, если относительная молекулярная масса оксида равна 40.
- Относительные молекулярные массы кислот Н3ЭО4 и Н2ЭО4 равны 98. Определите место расположения этих элементов в периодической системе.
- Относительная молекулярная масса соединения Э(ОН)2 равна 58. Охарактеризуйте строение атома этого элемента.
