Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 15
§29. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ НЕКОТОРЫХ ХАРАКТЕРИСТИК И СВОЙСТВ
Периоды, группы.
Периодическая система является графическим изображением Периодического закона Д. И. Менделеева. Она состоит из восьми групп и семи периодов. Периоды подразделяются на большие и малые. Первые три периода — малые, они состоят из одного ряда. Большие периоды состоят из двух рядов.
Далее рассмотрим изменение свойств атомов элементов (радиусы, металлические и неметаллические свойства, валентности) и их соединений (кислотно-основные свойства оксидов и гидроксидов).
Хотя число энергетических уровней у элементов одного периода одинаково, по периоду слева направо радиусы атомов уменьшаются, так как заряды ядер атомов постепенно возрастают в этом направлении.
По периодам слева направо увеличивается число электронов на внешнем энергетическом уровне, что приводит к ослаблению металлических свойств и усилению неметаллических свойств.
У атомов металлов мало электронов на внешних энергетических уровнях (1—3), поэтому они легко их отдают.
У атомов неметаллов для завершения внешнего энергетического уровня не хватает 1—4 электронов, поэтому неметаллы легко их принимают. Их валентность в водородных соединениях определяется числом присоединенных электронов.
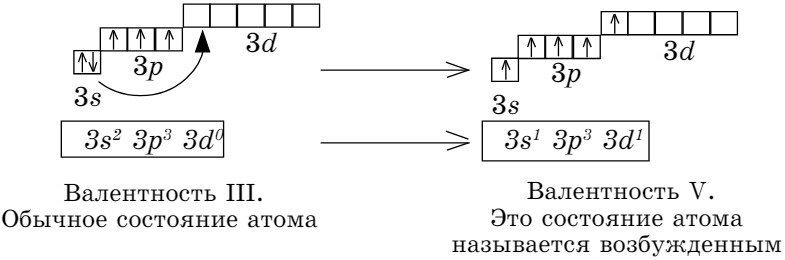
На примере атома фосфора рассмотрим валентность элемента. Валентность атомов элементов с точки зрения электронного строения атомов определяется участием неспаренных электронов в образовании химических связей между атомами. Электронная формула последнего энергетического уровня атома фосфора:
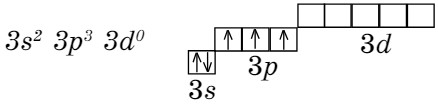
Третий энергетический уровень состоит из трех подуровней 3s, 3р, 3d. На 3d-орбитали 5 ячеек.
Валентных электронов пять, три из них неспаренные. На 3р-орбитали находятся три неспаренных электрона, поэтому фосфор проявляет валентность, равную III (Р2О3, Н3РО3). При подаче определенного количества энергии один электрон с 3s-орбитали переходит на 3d-орбиталь, такое состояние атома называется возбужденным. В результате атом фосфора становится пятивалентным (Р2О5, Н3РО4). В водородных соединениях фосфор трехвалентен (РН3), так как до завершения внешнего энергетического уровня не хватает 3 электронов (8-5 = 3).
Оксиды первых двух элементов каждого периода Периодической системы являются основными оксидами, которым соответствуют основные гидроксиды. Далее идут элементы, оксиды и гидроксиды которых проявляют амфотерность. В конце периодов расположены элементы, оксиды и гидроксиды которых проявляют кислотные свойства.
Каждая группа Периодической системы подразделяется на две подгруппы: главную (А) и побочную (В).
Число валентных электронов элементов одной группы одинаково. Валентные электроны элементов главных подгрупп (А) расположены на внешних энергетических уровнях.
Высшая валентность в соединениях элементов одной группы одинаковая.
Элементы побочных подгрупп - металлы, у многих из них на внешнем энергетическом уровне имеется по два электрона, поэтому их низшая валентность равна II, а высшая соответствует номеру группы, они проявляют переменную валентность. Исключение: цинк имеет постоянную валентность (II) а, например, медь и серебро — низшую валентность (I).
В главной подгруппе сверху вниз увеличиваются значения атомных радиусов, так как увеличивается число энергетических уровней. Поэтому уменьшается количество энергии, необходимой для отрыва электрона от внешнего электронного слоя, что приводит к усилению металлических свойств.
Основываясь на этих рассуждениях, можно сделать следующий вывод:
Свойства химических элементов и образуемых ими простых и сложных веществ периодически повторяются, так как периодически изменяется электронное строение атомов.
Валентные электроны, переменная валентность.
А
- Назовите элемент, формула валентных электронов которого 3s23p5.
- Какому элементу соответствует электронная формула 1s22s22p63s23p2? Определите место расположения элемента в Периодической системе Д. И. Менделеева. Сколько у атома этого элемента энергетических уровней, а также протонов, нейтронов и электронов?
- Напишите электронную формулу элемента, атомный номер которого 20. Определив валентность этого элемента, составьте формулы его оксида и гидроксида.
В
- Какие валентности характерны для атома серы в соединениях? Объясните с помощью электронно-графических формул.
- Объясните, почему валентности углерода в углекислом газе (СО2) и метане (СН4) одинаковы.
- Почему значение валентности элементов: углерода, азота, кислорода и фтора в водородных соединениях снижается с IV до I?
C
- Определите место расположения элемента в Периодической системе, если электронная формула его атома 1s22s22p63s23p4. Какие валентности характерны для этого элемента? Напишите формулы его оксидов и гидроксидов.
- У какого элемента и почему более выражены металлические свойства: а) натрий - алюминий; б) литий - калий?
- Выберите ряд элементов, в котором усиливается способность отдавать электроны: О → S → Se → Те; Ве → В → С → N.
- Укажите наиболее активный элемент: а) неметалл III периода; б) металл III периода.
Играем, думаем, учимся!
При правильном заполнении вы прочитаете названия 12 химических элементов.
§30. ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ПО ПОЛОЖЕНИЮ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
Протоны, нейтроны, заряд ядра, относительная атомная масса.
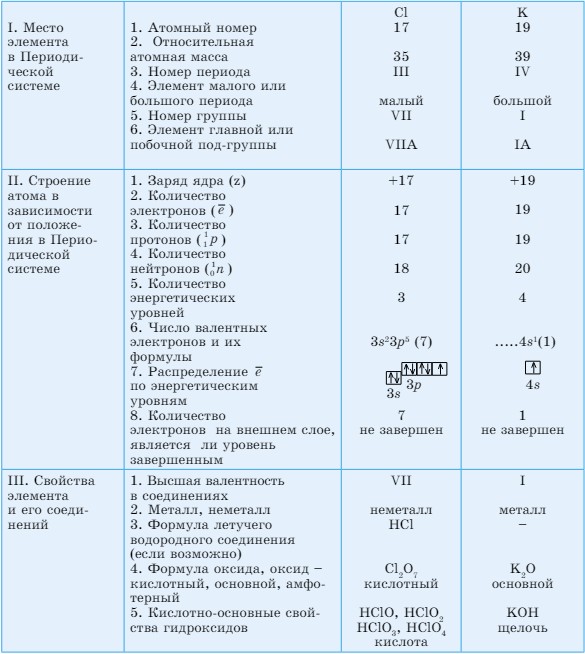
После того как мы выяснили зависимость свойств химических элементов от электронного строения атома, можно предположить свойства любого элемента Периодической системы (табл. 12). Для этого предлагаем следующий алгоритм:
- Место химического элемента в Периодической системе.
- Строение атома химического элемента в зависимости от положения в Периодической системе.
- Свойства химического элемента и его соединений.
Таблица 12. Характеристика элементов (Сl, К)
А
- Напишите формулы оксидов и гидроксидов следующих элементов: барий, цинк, сера, сурьма.
- Выберите ряд элементов, в котором усиливается способность присоединять электроны:
- Si - Р - S - Сl;
- F - О - N - С.
- Как изменяется способность элементов (усиливается, ослабевает) отдавать электроны в следующих рядах:
- Ве — Мg — Са — Sr - Ва;
- Mg - Аl - Si - Р - S - С1?
Почему?
В
- Как изменяются свойства:
- металлические: Li → Na → К → Rb;
- неметаллические: F → Сl → Вr → I;
- As → Se → Вr?
- Какое из приведенных оснований обладает более сильными основными свойствами: NaОH → Мg(ОН)2 → Аl(OН)3. Почему?
- Формула оксида элемента III периода в высшей валентности ЭО2. Определите этот элемент и охарактеризуйте строение его атома.
С
- Элемент IV периода образует оксид ЭО3. Составьте формулу его водородного соединения.
- Относительная молекулярная масса кислоты Н2ЭО3 равна 62. Напишите формулы оксидов, а также формулу водородного соединения кислотообразующего элемента.
- Элемент образует с водородом соединение Н2Э, относительная молекулярная масса которого равна 34. Определите этот элемент, характер его гидроксидов. Напишите их формулы.
ДЕЛАЕМ ВЫВОДЫ
- Период - горизонтальный ряд элементов в Периодической системе, который начинается со щелочного металла и заканчивается инертным газом. В периодах число энергетических уровней одинаково, элементы расположены по возрастанию зарядов ядер атомов.
- Группа - вертикальный ряд сходных по свойствам элементов, у которых число валентных электронов одинаково. Валентные электроны элементов главных подгрупп расположены на внешнем энергетическом уровне, у элементов побочных подгрупп - на внешних и предвнешних уровнях.
- По периодам слева направо металлические свойства постепенно ослабевают, а неметаллические - усиливаются, так как в этом направлении уменьшаются радиусы атомов и увеличивается число электронов на последнем уровне.
- По группам сверху вниз из-за увеличения атомных радиусов усиливаются металлические свойства, а неметаллические - ослабевают.
ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА. ЖИЗНЬ И ДЕЯТЕЛЬНОСТЬ Д. И. МЕНДЕЛЕЕВА
Периодический закон и Периодическая система элементов Д. И. Менделеева оказали огромное влияние на развитие не только химии, но и теоретической физики, астрономии, медицины, геологии и многих других наук. Руководствуясь Периодическим законом, ученые-физики определили электронное строение атомов.
Д. И. Менделеев открыл фундаментальный закон периодичности изменений свойств элементов и на основе этого закона создал свою знаменитую таблицу химических элементов.
На основе открытого им закона Д. И. Менделеев удивительно точно предсказал физико-химические свойства еще не открытых в то время элементов, заложив тем самым методологическую основу неорганической химии (экаалюминий - галлий, экабор — скандий, экасилиций - германий).
Периодический закон утвердился в науке и стал путеводной звездой в поисках еще не открытых в земной природе элементов, а также еще не полученных соединений уже известных элементов.
Периодическая система привела в строгий порядок огромное число фактов и разрозненных знаний о химических элементах и их соединениях. Опираясь на Периодический закон, ученые-физики синтезировали ряд трансурановых элементов, которые дополнили Периодическую систему и оказались дополнительным свидетельством ее правильности.
В Периодическом законе нашли свое отражение важнейшие законы диалектики.
Заслуги Д. И. Менделеева были отмечены американским ученым Г. Сиборгом, который назвал открытый им элемент №101 менделеевием.
Дмитрий Иванович Менделеев родился 27 января (8 февраля) 1834 г. в г. Тобольске в Сибири. Его отец был директором городской гимназии. После окончания гимназии будущий ученый поступил в Петербургский педагогический институт, который окончил в 1857 г. с золотой медалью. Свои первые научные работы он опубликовал еще в студенческие годы.
После защиты магистерской диссертации в 1859 г. Д. И. Менделеев был командирован в заграничную научную поездку в Германию. Вернувшись на родину, он с головой уходит в науку и педагогическую деятельность. После двух лет профессорской деятельности в Петербургском технологическом институте переходит в университет, где успешно работает в течение 23 лет.
В 1876 г. Д. И. Менделеев был избран членом-корреспондентом Петербургской академии наук.
Д. И. Менделеев был человеком широких, прогрессивных взглядов, крупным общественным деятелем, много сил отдавал развитию народного образования. Во время студенческих волнений 1890-х годов ученый выступил на стороне студентов и был вынужден уйти из университета.
Последние годы жизни Д. И. Менделеев возглавлял Палату мер и весов.
Круг его научных интересов не ограничивался химией. Он является автором фундаментальных исследований по физике, метрологии, химической технологии, экономике, воздухоплаванию, сельскому хозяйству и др. Его работы не утратили своего значения и в наши дни.
Любознательный ум ученого не ведал страха. Исследуя земную атмосферу, он в одиночку совершил полет на воздушном шаре. «Заболев» освоением Арктики, он разработал проект ледокола. Также Д. И. Менделеев разработал состав бездымного пороха.
Д. И. Менделеев тщательно изучал нефтяные месторождения, самое серьезное внимание уделял вопросам технологии нефти, считая нефть важнейшим сырьем для получения многих ценных химических продуктов.
Вершиной его творческой деятельности, бесспорно, является открытый им Периодический закон и созданная на его основе Периодическая система химических элементов. Д. И. Менделеевым написан первый российский учебник по неорганической химии «Основы химии», в котором свойства неорганических соединений впервые описаны на основе Периодического закона.
За выдающиеся заслуги в науке Д. И. Менделеев был избран почетным членом академий и научных обществ многих стран мира; удостоен золотой медали им. М. Фарадея.
В возрасте 73 лет он скончался. Проститься с одним из величайших ученых мира пришло множество людей. Впереди процессии несли Периодическую таблицу.
