Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 16
§31. ЕСТЕСТВЕННЫЕ СЕМЕЙСТВА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СВОЙСТВА. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
В любой отрасли науки по мере накопления фактов возникает необходимость в их систематизации и установлении внутренней причинноследственной связи между ними.
Из курса биологии вы хорошо знакомы с систематизацией в растительном и животном мире. В химии накопление знаний об элементах и их соединениях привело к необходимости их группировки по сходным признакам.
Классификация элементов началась с деления их на металлы и неметаллы, что было предложено шведским химиком Й. Я. Берцелиусом.
Кроме металлов и неметаллов существуют химические элементы, которые проявляют двойственную природу, т. е. обладают свойствами и металлов, и неметаллов в зависимости от условий протекания химических реакций (Be, Zn, Al и др.). Их оксиды и гидроксиды называют амфотерными веществами (от греческого amphoteros - оба, тот и другой).
В природе существуют группы элементов со сходными химическими свойствами, их называют естественными семействами элементов. К типичным металлам относятся щелочные металлы. Кроме этих металлов мы будем рассматривать группу галогенов (VIIА) и инертных газов.
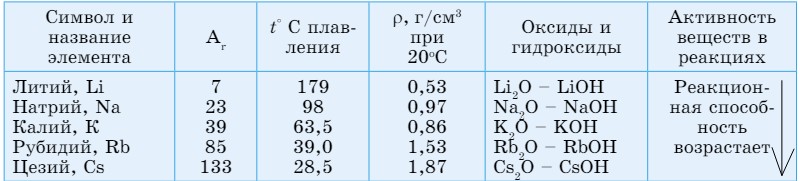
Щелочные металлы расположены в IА группе. Это литий (Li), натрий (Nа), калий (К), рубидий (Rb), цезий (Сs), франций (Fr). Франций - радиоактивный элемент. Они называются щелочными металлами, потому что при взаимодействии с водой образуют сильные растворимые основания - щелочи (рис. 39). Общая электронная формула валентных электронов ns1 (п = 2 - 7).

Щелочные металлы обладают некоторыми общими свойствами: молекулы щелочных металлов состоят из одного атома, очень активные. Поэтому их нужно хранить под слоем керосина. Энергично реагируют с водой, в соединениях проявляют валентность, равную I.
Металлическая активность щелочных металлов усиливается сверху вниз по группе, что связано с возрастанием атомных радиусов в этом направлении.
У щелочных металлов валентные электроны расположены на s-орбитали, поэтому их называют s-элементами. s-элементы в обычных условиях - это кристаллические вещества, которые по сравнению с остальными металлами обладают малыми значениями плотности (табл. 13). Литий, калий и натрий легче воды (p = 0,53 — 0,86 г/см3), поэтому они плавают на ее поверхности. У этих элементов температуры плавления и кипения также имеют низкие значения. Щелочные металлы и их соединения окрашивают пламя: натрий - в желтый, калий - в красно-фиолетовый, литий - в карминово-красный, рубидий - в розово-фиолетовый цвета (рис. 40).
Таблица 13. Некоторые характеристики щелочных металлов
| Название и символ | Атомная масса | Формула валентных электронов | Радиус атомов, нм | Электроотрицательность |
| Литий (Li) | 7 | 2s1 | 0,152 | 1,0 |
| Натрий (Na) | 23 | 3s1 | 0,190 | 0,9 |
| Калий (К) | 39 | 4s1 | 0,227 | 0,8 |
| Рубидий (Rb) | 85 | 5s1 | 0,248 | 0,8 |
| Цезий (Cs) | 132 | 6s1 | 0,265 | 0,7 |
Щелочные металлы имеют на внешнем энергетическом уровне по одному электрону, который слабо связан с ядром из-за больших значений

атомных радиусов. Они легко отдают эти электроны (Ме°-1ē → Ме+1), при этом принимают электронное строение впереди стоящего инертного газа. В соединениях проявляют постоянную валентность, равную I.
Литий по своим свойствам несколько отличается от остальных металлов. С водой литий взаимодействует медленно, натрий - более энергично, калий - наиболее энергично реагирует с водой, вспыхивает фиолетовым пламенем, а рубидий - со взрывом.
Оксиды этих элементов являются основными, им соответствуют основания, хорошо растворимые в воде, - щелочи, основные свойства которых усиливаются сверху вниз по группе.
Литий был открыт в 1817 г. шведским ученым Арфедсоном, натрий и калий - в 1807 г. английским ученым Г. Дэви, рубидий и цезий - в 1861 г. Р. Бунзеном.
Литий используют для изготовления различных свинцовых и алюминиевых сплавов, которые применяются в самолетостроении. Добавка лития к сплавам увеличивает их твердость.
Рубидий и цезий используют для изготовления фотоэлементов.
Таблица 14. Щелочные металлы и их свойства
А
- Как образуются ионы щелочных металлов и галогенов?
- Дайте характеристику щелочных металлов по группе.
- Какие естественные семейства элементов вам известны? Укажите их место в Периодической системе Д. И. Менделеева. Что их объединяет?
В
- Как изменяются радиусы щелочных металлов в направлении Li—Cs? Объясните причину.
- Как определяют соединения щелочных металлов?
- Относительная молекулярная масса основания Mr(ЭOH) = 24. Определите элемент и охарактеризуйте его по месту в периодической системе.
С
- Достаточно ли 0,15 моль серной кислоты для нейтрализации 8,4 г гидроксида калия?
- Одинаковы ли объемы водорода, выделившиеся при взаимодействии 14 г лития и 46 г натрия с водой. Ответ обоснуйте расчетами.
- Сколько граммов серной кислоты необходимо для нейтрализации 20 г гидроксида натрия?
Ответ: 24,5 г.
§32. ГАЛОГЕНЫ И ИНЕРТНЫЕ ГАЗЫ
Какие галогены и инертные газы вы знаете? Где они применяются? Что вы знаете об инертных газах? Расскажите об их применении.
В природе существуют группы элементов с противоположными щелочным металлам свойствами, к примеру, галогены (табл. 15).
Таблица 15. Галогены и их свойства
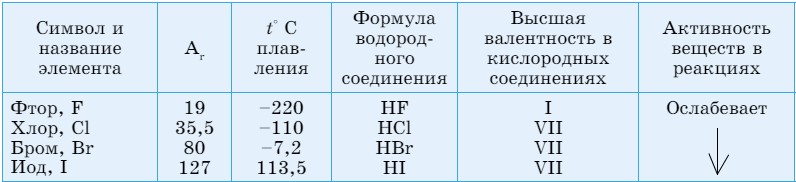
Галогены - типичные неметаллы, при взаимодействии с металлами образуют соли (галоген означает солерод). Молекулы галогенов двухатомные. Все галогены образуют летучие водородные соединения, растворы которых являются кислотами. В отличие от щелочных металлов, активность элементов по мере возрастания относительных атомных масс у галогенов ослабевает.
Галогены расположены в VIIА группе. Это фтор F, хлор Сl (рис. 41), бром Вr, йод I, астат Аt. Астат - радиоактивный элемент.
Электронная конфигурация внешнего слоя этих элементов пs2 пр5 (п = 2 - 6). (табл. 16).
Таблица 16. Некоторые свойства галогенов
| Название и символ | Атомная масса | Формула валентных электронов | Радиус атомов, нм | Электроотрицательность | Температура кипения, °С | Агрегатное состояние, цвет |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Фтор (F) | 19 | 2s22р5 | 0,064 | 4,0 | -108 | Зеленоватый газ |
продолжение:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Хлор (Сl) | 35,5 | 3s23р5 | 0,099 | 2,8 | –35 | Желтозеленый газ |
| Бром (Вг) | 80 | 4s24р5 | 0,114 | 2,7 | 58,8 | Красно-бурая жидкость |
| Иод (I) | 127 | 5s25р5 | 0,133 | 2,2 | 183 | Чернокрасные кристаллы |

Последний электрон у атомов галогенов поступает на р-орбиталь, поэтому они называются р-элементами. По группе сверху вниз радиусы атомов увеличиваются, в том же направлении растут значения температур кипения и плотности. Агрегатные состояния переходят из газообразного (F2, Сl2) через жидкое (Вr2) в твердое (I2), а окраска сгущается (от желто-зеленой у хлора до черно-серого с фиолетовым блеском у йода).
Галогены - типичные неметаллы, на внешнем энергетическом уровне у них не хватает одного электрона для завершения слоя, поэтому они легко принимают один электрон, проявляя неметаллические свойства. При этом принимают электронное строение инертного газа, стоящего после них в периодической системе. Кроме фтора, все остальные галогены образуют кислотные оксиды.
В соединениях фтор проявляет валентность, равную I. Остальные галогены проявляют валентности I, III, V, VII.
Неметаллические свойства элементов в группе сверху вниз ослабевают, так как из-за увеличения атомных радиусов сила притяжения электронов к ядру уменьшается.
Еще одна природная группа элементов - инертные газы (табл. 17).
Каждый период в Периодической системе завершается инертным газом. Инертные газы характеризуются низкой химической активностью. Из-за чего такая пассивность? Для разрешения этого вопроса рассмотрим электронное строение этих элементов. У известных вам инертных газов 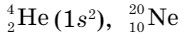
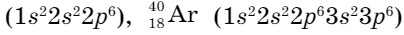 внешний слой завершен (у гелия - два, у аргона и неона - по восемь электронов).
внешний слой завершен (у гелия - два, у аргона и неона - по восемь электронов).
Таблица 17. Сравнительная характеристика инертных газов
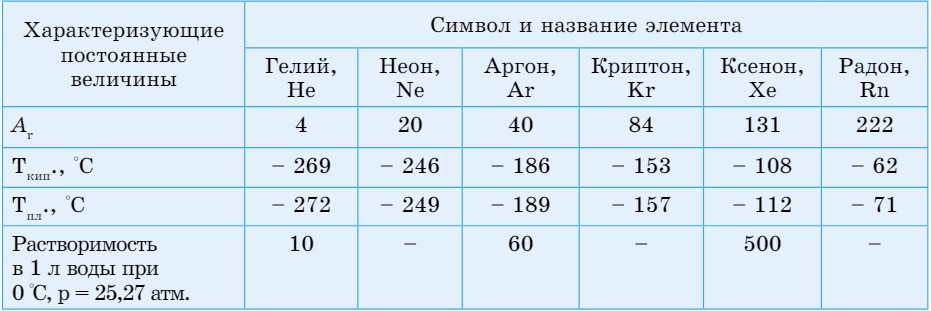
Это одноатомные газы без цвета и запаха. Среди них самым химически инертным является гелий, более активны криптон и ксенон. В направлении возрастания относительной атомной массы, от Не до Хе, наблюдается возрастание температуры кипения и плавления. Усиливается также растворимость газов в воде и других растворителях.

Гелий обнаружен в атмосфере Солнца и других звезд. В земной атмосфере и коре гелий может накапливаться в результате распада радиоактивных элементов. Он состоит из двух изотопов: 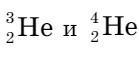 , неон и аргон - из трех:
, неон и аргон - из трех: 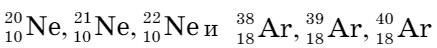 . Криптон на Земле встречается в виде шести изотопов, ксенон - девяти, а радон не имеет устойчивых изотопов.
. Криптон на Земле встречается в виде шести изотопов, ксенон - девяти, а радон не имеет устойчивых изотопов.
Аргон более распространен на Земле, его содержание в земной атмосфере составляет 0,9%.
Инертные газы (Не, Не, Аг) применяются в основном при сварке металлов, в лампах, в фонарях, а также как хладагенты при физических исследованиях (рис. 42).
Изучение свойств естественных семейств химических элементов и их соединений помогает нам систематизировать наши знания.
Знаешь ли ты?
Йод был открыт при «помощи» кошки. Французский ученый Б. Кур- туа приготовил в двух склянках два различных раствора: в первой - концентрированную Н2SО4, во второй - спиртовый раствор морских водорослей. В это время на плече ученого сидела кошка, она прыгнула и опрокинула обе склянки. Эти вещества прореагировали с образованием сине-фиолетового газа. При охлаждении он превратился в фиолетовые кристаллы. Так в 1811 г. был открыт йод.
2NaI + 2Н2SО4 = I2 + SО2 + Nа2SО4 + 2Н2О
А
- Назовите галогены и инертные газы. Дайте их характеристику по Периодической системе Д. И. Менделеева.
- Какие природные изотопы хлора вам известны?
В
- К каким оксидам относятся оксиды галогенов: а) основным; б) кислотным?
- Какой объем хлороводорода образуется при взаимодействии 30 л хлора с водородом?
С
- В природе встречаются два изотопа неона 20Ne и 22Ne в составе атмосферы. Содержание 20Ne — 90,9%. Определите относительную атомную массу неона?
- Сколько граммов брома образуется при пропускании хлора через раствор, содержащий 47,6 г бромида калия? К какому типу относится данная реакция?
- Что общего у этих частиц: S2-, Сl-, Аr?
А. Электронная конфигурация
В. Валентность
С. Заряд ядра
D. Относительная атомная масса
E. Число энергетических уровней.
