Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 17
§33 МЕТАЛЛЫ И НЕМЕТАЛЛЫ
Вы знаете, что простые вещества в зависимости от электронного строения атомов подразделяются на металлы и неметаллы. Рассмотрим их структуру, свойства и применение в сравнительном аспекте. Обратите внимание на их различия и с чем они связаны.
В периодах в I, II, III группах находятся в основном металлы, а в IV-VIII главных подгруппах в основном расположены неметаллы.
Если провести диагональ от бора к астату, то справа вверх от диагонали расположены элементы - неметаллы (кроме элементов побочных подгрупп), а слева вниз - элементы металлы. На внешних энергетических уровнях металлов вращаются в основном 1-3 электрона, у неметаллов 4-8 электронов.
Электронное строение металлов пs1-2пр1-2 и неметаллов пs2пр2-6. Радиусы атомов металлов большие, неметаллы характеризуются малыми значениями радиусов.
В химических реакциях металлы отдают электроны
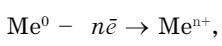
неметаллы присоединяют и могут отдавать электроны, кроме фтора.
Металлы, кроме ртути, твердые вещества, а неметаллы - твердые (S, Р, С, Si, I2), жидкие (Вг2) и газообразные (N2, О2, Сl2, Н2, F2).
Металлы и их соединения применяются в тяжелой индустрии, а соединения неметаллов применяются в пищевой, бумажной и текстильной промышленности.
Металлы встречаются в литосфере, а соединения неметаллов чаще находятся в атмосфере.
По распространенности металлы подразделяются на благородные (Au, Ag, Pt), редкие, рассеянные, макро- и микроэлементы; неметаллы по содержанию в живых организмах - на макро-, микро- и ультраэлементы. В недрах земли они встречаются в виде минералов, в морских и водах океанов - в виде соединений.
Оксиды металлов I-II главных подгрупп - основные оксиды, им соответствуют гидроксиды: СаО → Са(ОН)2. Оксиды неметаллов главных подгрупп VI—VII групп - кислотные оксиды, им соответствуют кислоты:
СО2 → H2CO3
Металлы не образуют летучие водородные соединения. Неметаллы образуют летучие водородные соединения кислотного характера, например, H2S, HCl, HF, HBr, HI. А некоторые неметаллы образуют водородные соединения, проявляющие основные свойства в водных растворах, например, NH3 и РН3.
Металлы обладают характерной особенностью - металлическим блеском, легко куются, вытягиваются, гнутся и прокатываются.
Металлы хорошо проводят электричество и тепло, они хорошие проводники. Из неметаллов хорошим проводником электрического тока является графит. Многие соединения неметаллов (кристаллический кремний) проявляют полупроводниковые свойства или являются диэлектриками.
А
- Где расположены металлы и неметаллы в Периодической таблице?
- Дайте сравнительную характеристику металлам и неметаллам по распространению в природе и агрегатным состояниям.
В
- Какие элементы образуют летучие водородные соединения?
- Как изменяются металлические и неметаллические свойства по группам и периодам?
- Определите объемные и массовые отношения газов синтеза галогеноводоро- дов (НГ).
С
- Спрогнозируйте свойства химических элементов: рубидия (Rb), брома (Br) по положению в Периодической системе.
- Как изменяются неметаллические свойства в направлении германий - бром?
- Подготовьте эссе или презентацию по значению и применению металлов и неметаллов.
Словарь по теме «Периодическая таблица химических элементов»
| № | Русский | Казахский | Английский |
| 1 | химическая формула | химиялық формула | chemical formula |
| 2 | период | период | period |
| 3 | большой период | үлкен период | grand period |
| 4 | малый период | кіші период | small period |
| 5 | группа | топ | group |
| 6 | главная подгруппа | негізгі топша | major subgroup |
| 7 | побочная подгруппа | қосымша топша | side subgroup |
| 8 | естественные семейства элементов | элементтердің табиғи ұяластары | natural elements family |
| 9 | щелочные металлы | сілтілік металдар | alkaline metals |
| 10 | щелочноземельные металлы | сілтілік-жер металдары | alkaline earth metals |
| 11 | галогены | галогендер | halogens |
| 12 | инертные газы | бекзат газдар | noble gases |
ДЕЛАЕМ ВЫВОДЫ
- Периодическая система состоит из 7 периодов, 8 групп.
- Периоды подразделяются на малые (1-3) и большие (4-7).
- Каждая группа состоит из двух подгрупп: главной (А) и побочной (В).
- Порядковый номер элемента указывает на заряд его ядра.
- Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда атомных ядер.
- Группы элементов со сходными физическими и химическими свойствами называются естественными семействами.
- Формулы валентных электронов щелочных металлов пs1, галогенов - пs2 пр5, а инертных газов - пs2 пр6 (кроме гелия).
- Щелочные металлы - легко отдают один электрон с внешнего энергетического уровня, а галогены легко присоединяют недостающий до завершения внешнего слоя один электрон.
В группе металлические свойства щелочных металлов усиливаются сверху вниз, а у галогенов неметаллические свойства в этом направлении ослабевают.
Глава IX. ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ.
Как образуются соединения? Что такое ионы? Как они образуются?
После ознакомления и подробного изучения Периодической системы Д. И. Менделеева можно приступить к изучению способности элементов образовывать химические соединения.
Химическая активность элементов определяется незавершенностью внешнего энергетического уровня. Элементы могут завершить внешние уровни путем присоединения или отдачи электронов при образовании химических соединений. Эта способность определяется двумя факторами:
- электронным строением элементов;
- значением атомного радиуса.
В периодах слева направо увеличивается число электронов на внешнем энергетическом уровне (валентные электроны) элементов. В этом же направлении растут и значения заряда ядер атомов. Усиливается сила притяжения электрона к ядру. Поэтому постепенно уменьшаются значения атомных радиусов (табл. 18). Усиливается способность завершить энергетический уровень путем присоединения электронов. Для того чтобы убедиться в этом, рассмотрим строение внешних энергетических уровней элементов 3-го периода и определим число электронов, недостающих для их завершения (табл. 19).
Таблица 18. Радиусы атомов некоторых химических элементов главных подгрупп (в нм)

Таблица 19. Способность к завершению внешних энергетических уровней элементов 3-го периода
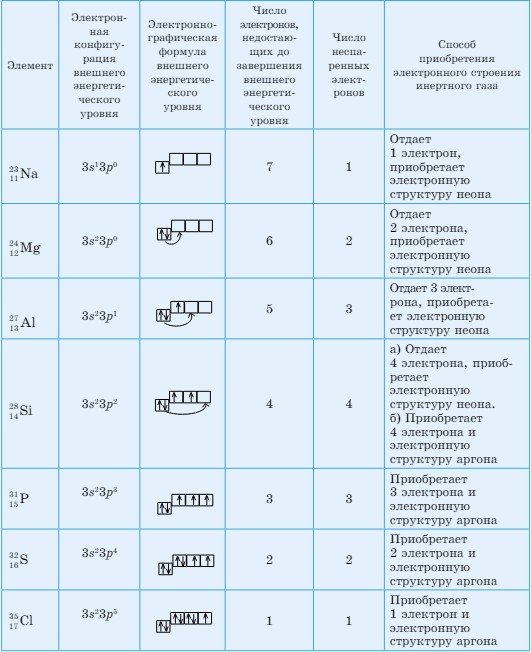
У элементов, расположенных в начале периода (IA, IIA), на внешнем энергетическом уровне имеется мало электронов. Поэтому они их легко отдают, принимая при этом электронное строение инертного газа, которым завершается предыдущий период. А у элементов, расположенных в конце периода (VIA, VIIA), на внешнем энергетическом уровне не хватает одного или двух электронов. Они с легкостью присоединяют, принимая электронное строение инертного газа, которым завершается данный период.
Величина, по которой определяется легкость отдачи или присоединения электрона элементом, называется электроотрицательностью.
Электроотрицательность — величина, характеризующая свойство атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей от других атомов в соединениях.
У элементов одной группы число валентных электронов одинаково. А число энергетических уровней, т. е. радиусы атомов, увеличивается сверху вниз, значит, усиливается способность отдавать электрон с внешнего уровня.
Электроотрицательность является универсальной характеристикой металлических и неметаллических свойств элементов.
Чем меньше электроотрицательность, тем ярче выражены металлические свойства. Чем больше электроотрицательность, тем ярче выражены неметаллические свойства.
Электроотрицательность элементов в периодах увеличивается слева направо, в группах — снизу вверх (табл. 20).
На практике используется понятие относительной электроотрицательности, которое ввел в науку американский ученый Л. Полинг. Ее значение меняется от 0,7 до 4,0. Цезий - элемент с наименьшим (0,7), а фтор - с наибольшим (4,0) значением электроотрицательности.
Физический смысл этого понятия сводится к объяснению способности элемента завершить свой незавершенный энергетический уровень при взаимодействии с другими элементами.
Вам уже известно, что при образовании ионов типичные металлы отдавая, а типичные неметаллы принимая электрон завершают свои энергетические уровни. Первые из них заряжаются положительно, а вторые - отрицательно.
Таблица 20. Относительная электроотрицательность некоторых химических элементов

А

В
- Как изменится значение атомных радиусов в направлениях Ва — Сl, Ве — F?
- Определите более электроотрицательные элементы в следующих парах: Мg - Сl, К - F. Объясните с точки зрения электронного строения атомов.
- Определите заряды элементов в следующих соединениях: НС1; С12О7, МgО, Н3Р, Н2О.
C
- Определите заряды кислотообразующих элементов: Н2S, Н2SО3, НNО3, НNО2, H3PO4.
- В нижней части периодической системы даны общие формулы оксидов элементов в высших валентностях и формулы водородных соединений неметаллов. Какой вывод можно сделать о зарядах неметаллов в кислородных и водородных соединениях?
- Укажите смещения электронов в следующих парах: Nа - Р, Nа - S, Nа - Сl.
