Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 18
§35. КОВАЛЕНТНАЯ СВЯЗЬ
Молекулы, как известно, состоят из атомов. А как атомы соединены между собой?
При образовании химических связей происходят изменения во внешних энергетических уровнях элементов. Существуют четыре типа химических связей, из которых мы подробно рассмотрим пока два.
Ковалентная связь образуется между атомами неметаллов. Ковалентная связь осуществляется путем образования общей электронной пары между элементами.
Образование химических связей можно объяснить, используя понятие электроотрицательности элементов.
Рассмотрим образование молекулы водорода, когда химическая связь образуется между элементами с одинаковыми значениями электроотрицательности. Электронная формула атома водорода 1s1, электроотрицательность водорода равна 2,1. Форма электронных облаков s-электрона сферическая (шарообразная), их взаимодействие можно изобразить следующим образом (рис. 43).
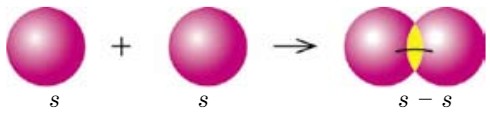
Теперь рассмотрим, как образуется связь между атомами в молекуле водорода (Н2).
При перекрывании электронных облаков двух s-электронов образуется электронная пара, общая для обоих атомов, которая находится на одинаковом расстоянии от обоих ядер. Такая связь называется ковалентной неполярной (рис. 44).
Неполярная ковалентная связь образуется между атомами с одинаковой электроотрицательностью (ЭО).
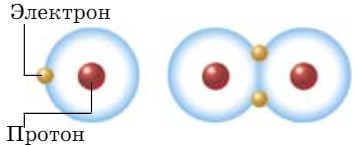
Для того чтобы легче воспринимать образование связи, электроны обозначают точками.
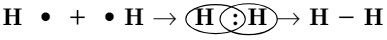
Из этой записи видно, что при образовании молекулы водорода каждый атом приобретает завершенный электронный слой. В графических формулах молекул одной электронной паре соответствует одна черточка 
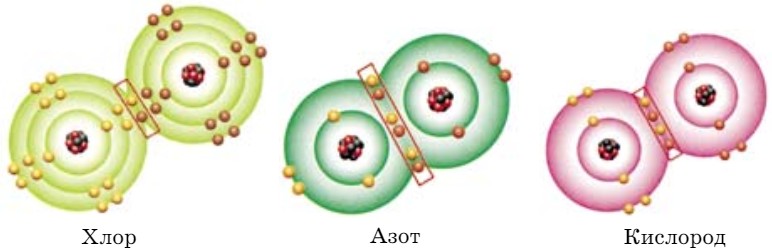
 . Валентность атомов водорода равна I, потому что валентность определяется числом электронов, участвующих в образовании химической связи. Связь образована между атомами с одинаковыми значениями электроотрицательности. Такая связь возникает в молекулах простых веществ, таких как Сl2, N2, O2 (рис. 45).
. Валентность атомов водорода равна I, потому что валентность определяется числом электронов, участвующих в образовании химической связи. Связь образована между атомами с одинаковыми значениями электроотрицательности. Такая связь возникает в молекулах простых веществ, таких как Сl2, N2, O2 (рис. 45).
На примере молекулы кислорода можно также проследить механизм образования ковалентной неполярной связи. Электронная формула атома кислорода 1s22s22р4, валентные электроны 2s22р4, электроотрицательность равна 3,5. Электронно-графическая формула электронов внешнего слоя кислорода:
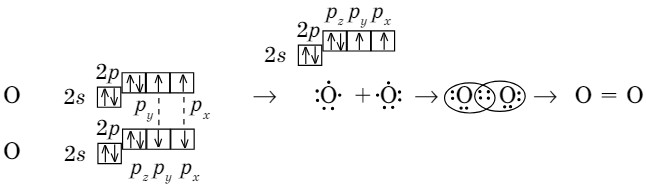
Число валентных электронов в атоме кислорода равно шести, но только два из шести являются неспаренными и участвуют в образовании химических связей.
Вокруг каждого ядра вращаются восемь электронов, т. е. каждый из атомов кислорода приобретает завершенный электронный слой.
Ковалентная полярная связь образуется между неметаллами, незначительно различающимися значениями электроотрицательности (ЭО).
Если два взаимодействующие элемента являются неметаллами, считается, что электрон смещается от элемента с меньшей электроотрицательностью к элементу с большим значением этого показателя. Поэтому первый из них заряжается положительно, а второй - отрицательно.
Рассмотрим образование связи в молекуле фтороводорода НF. Электроотрицательность фтора равна 4, а водорода — 2,1. Разница 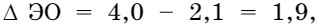 поэтому электроны смещаются в сторону более электроотрицательного элемента (F). Это показано направлением стрелки.
поэтому электроны смещаются в сторону более электроотрицательного элемента (F). Это показано направлением стрелки.
Существует также другой прием записи ковалентной связи: с помощью диаграммы «точек и крестов».
В молекуле данного соединения в образовании связи участвуют два разных атома. Поэтому электрон водорода, который участвует, обозначен «крестом», а фтора — «точками».
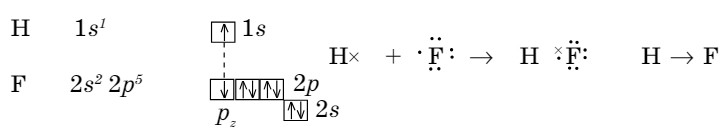
В данном случае каждый атом приобретает завершенный электронный слой (рис. 46).
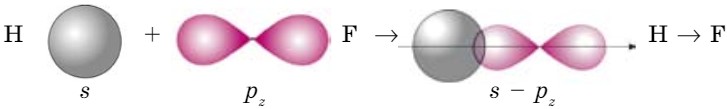
Но образующаяся общая электронная пара смещается в сторону более электроотрицательного элемента фтора. Это показано стрелкой.
В молекулах HF, H2O, NH3, HCl атомы связаны ковалентной полярной связью.
Ковалентной полярной связью называется связь, образующаяся между атомами с небольшой разницей электроотрицательности.
Электроотрицательность, ковалентная полярная, неполярная связь.
А
1. Как образуется ковалентная связь?
2. Какие известны виды ковалентной связи?
В
- Объясните образование молекулы хлора (Cl2).
- Какие связи образуются в молекуле аммиака (NH3)? Нарисуйте схему образования связи с помощью диаграммы «точек и крестов».
С
- Какие изменения происходят в электронном строении атомов при образовании из них молекул?
- Какая связь образуется в молекуле N2? Укажите связи с помощью диаграммы «точек и крестов».
§36. ИОННАЯ СВЯЗЬ
В рассмотренной нами молекуле фтороводорода общая электронная пара смещена в сторону фтора. Несмотря на это, электронное облако является общим для обоих атомов.
В молекулах, состоящих из атомов элементов, резко отличающихся значениями электроотрицательности, образуется ионная связь. Например, KF. Электроотрицательность калия 0,8; а фтора 4.
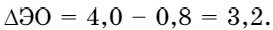
Электронная формула атома калия 1s2s22p63s23p64s1, а фтора 1s22s22р5.
В этом случае валентный электрон атома калия 4s1 переходит на внешний энергетический уровень атома фтора, в результате чего у обоих атомов образуется завершенный энергетический уровень:
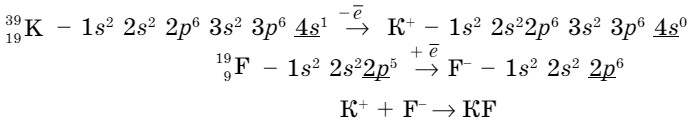
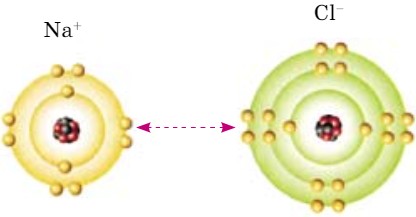
Атомы, отдавая или принимая электроны, превращаются в заряженные частицы - ионы. Разноименные ионы по законам электростатики притягиваются друг к другу, в результате чего образуется молекула с ионной связью. На рисунке 47 показана схема образования поваренной соли (NаСl). Какая связь образуется? Образуется ионная связь.
Положительно заряженные ионы называются катионами, отрицательно заряженные — анионами.
Ионная связь образуется между ионами за счет сил электростатического притяжения.
Ионная связь возникает между типичными металлами (IA, IIA) и типичными неметаллами (VIA и VIIA).
А
- Дайте определение ионной связи.
- Приведите примеры соединений с ионной связью.
В
- Объясните образование связи в хлориде кальция СаС12.
- Как изменяется характер связей в следующих соединениях: NaF, СаF2, НF и F2?
С
- Дайте определение катионам и анионам. Укажите разницу в электронном строении Сl0, Сl-; К0, К+.
- Классифицируйте данные вещества по типу химических связей в них: N2, H2S, Na2S, NH3, NaCl.
- Определите число электронов, нейтронов, протонов в следующих ионах: Сl-, Мg2+, S2-.
- По рисунку 47 определите следующее:
- сколько электронов вращаются на внешнем энергетическом уровне у атома натрия;
- определите заряд ядра атома натрия;
- определите число электронов иона натрия на внешнем энергетическом уровне;
- будет ли меняться числовое значение заряда ядра атома хлора при образовании иона;
- сколько электронов вращаются на внешнем энергетическом уровне у атома и иона хлора?
