Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 19
§37. ВЗАИМОСВЯЗЬ МЕЖДУ ТИПАМИ СВЯЗЕЙ, ВИДАМИ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК И СВОЙСТВАМИ ВЕЩЕСТВ
Любое вещество можно перевести в твердое состояние, создав определенные условия. Большинство твердых веществ при дроблении образуют мелкие кристаллики определенной формы, поэтому и называются кристаллическими. В кристаллических веществах ионы, атомы или молекулы расположены в строгом порядке, на определенных расстояниях, образуя кристаллические решетки.
Кристаллическая решетка - это пространственная структура, в которой структурные единицы (атомы, молекулы, ионы) закономерно повторяются
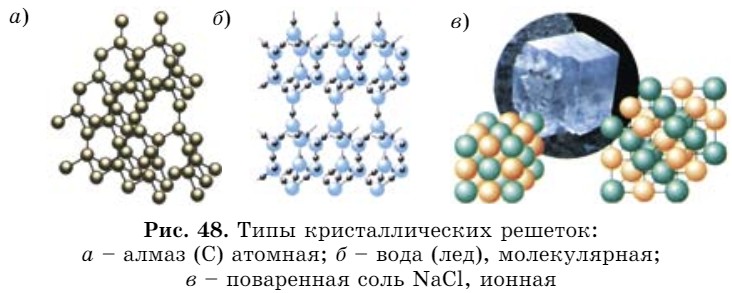
в узлах решеток. Кристаллической структурой определяются некоторые физические свойства веществ. По характеру частиц в узлах решетки кристаллические решетки делятся на три типа (рис. 48):
- атомная;
- молекулярная;
- ионная.
С помощью данных, приведенных в таблице 21, можно охарактеризовать каждый тип кристаллических решеток.
Таблица 21. Кристаллические решетки
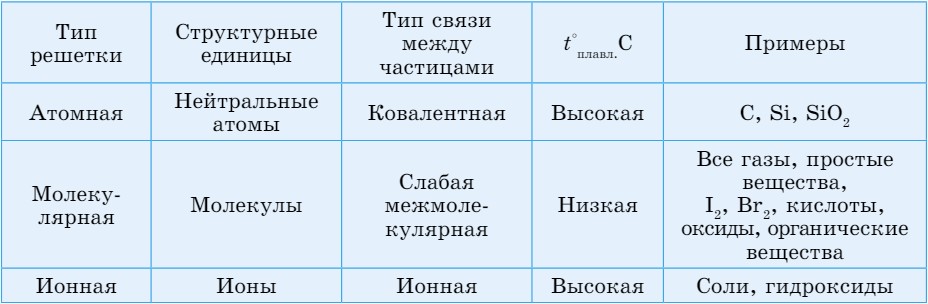
- В веществах с атомной кристаллической решеткой (рис. 48, а) связи ковалентные. В нормальных условиях это твердые, плохо растворимые вещества с высокими температурами плавления.
- Вещества с молекулярной кристаллической решеткой (рис. 48, б) характеризуются летучестью, при нагревании легко плавятся или разлагаются.
- Вещества с ионной кристаллической решеткой (рис. 48, в) растворяются в воде, их водные растворы и расплавы проводят электрический ток.
А
- Какими физическими свойствами обладает вещество с ионными кристаллическими решетками?
- Приведите по два примера по каждому типу химических связей.
В
- Определите типы химических связей в соединениях NaCl, СаF2, F2, Н2О, NH3, О2, используя таблицу электроотрицательностей.
- Как изменяется степень смещения связующих электронов в NaCl, МgСl2, АlСl3, SiCl4, РСl5?
- Используя рис. 48, дайте объяснение типам кристаллических решеток.
С
- Определите типы химических связей в соединениях, составьте их графические формулы: Сl2, КI, NaBr, НВr.
- При нагревании серы и йода в пробирках появляются в первом случае оранжевокрасные, а во втором - темно-красные пары. Какой кристаллической решетке соответствует данное свойство?
- Как изменяется доля ионной связи в хлоридах следующих металлов: Li, Na, К, Rb, Cs?
Словарь по теме «Химическая связь»
| № | Русский | Казахский | Английский |
| 1. | ковалентная связь | ковалентті байланыс | covalent bond |
| 2. | полярная ковалентная связь | полюсті ковалентті байланыс | polar covalent bond |
| 3. | неполярная ковалентная связь | полюссіз ковалентті байланыс | nonpolar covalent bond |
| 4. | кристаллическая решетка | кристалдың тор | crystal cell |
| 5. | электроотрицательность | электртерістілік | electronegativity |
| 6. | полярная молекула | полюсті молекула | polar molecula |
| 7. | неполярная молекула | полюссіз молекула | nonpolar molecula |
ДЕЛАЕМ ВЫВОДЫ
- Электроотрицательность - это способность атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей от других атомов в соединениях.
- Электроотрицательность зависит от числа электронов на внешнем энергетическом уровне и радиуса атома. Поэтому в периоде слева направо значения электроотрицательностей увеличиваются, а в группах сверху вниз — уменьшаются.
- Тип химической связи определяется с помощью понятия электроотрицательности элементов.
- Ковалентная связь осуществляется путем образования общей электронной пары между неметаллами.
- Ковалентная связь делится на полярную и неполярную: ковалентная неполярная связь образуется между элементами с одинаковой электроотрицательностью, а ковалентная полярная — между элементами с малой разницей в электроотрицательностях.
- Ионная связь образуется между ионами за счет сил электростатического притяжения.
- Заряженные частицы называются ионами, они образуются путем отдачи или присоединения элементом электронов.
- Типы кристаллических решеток веществ определяются видом химической связи в соединениях: ионная, атомная, молекулярная.
- Свойства веществ зависят от типа их кристаллических решеток и вида химической связи.
Глава X. РАСТВОРЫ И РАСТВОРИМОСТЬ
§38. РАСТВОРЕНИЕ ВЕЩЕСТВ В ВОДЕ. РАСТВОРИМОСТЬ
Какую формулу имеет вода? Расскажите о значении воды в природе и народном хозяйстве.
Вода — основная биологическая жидкость, инертный растворитель для многих органических и неорганических веществ. Вода необходима для всех живых организмов (рис. 49). Поваренная соль (NаСl) хорошо растворяется в воде (рис. 50).

Способность веществ переходить в раствор называется растворимостью. На растворимость веществ влияют различные факторы.
Растворимость многих твердых веществ увеличивается при повышении температуры. Для газообразных веществ растворимость повышается с увеличением давления и уменьшается с повышением температуры. Растворимость жидких веществ зависит от их химической природы. Спирт и серная кислота неограниченно растворяются в воде, бензин и растительное масло с ней даже не смешиваются.
Любая природная вода является раствором. Воды Каспийского моря содержат 13 г/л, Черного — 19 г/л, Мертвого — 260 г/л различных солей. Содержание солей в Мертвом море очень велико, поэтому в нем нет жизни. Морская вода является многокомпонентным раствором, так как в ней растворены различные вещества.
Раствор — это однородная система, образованная несколькими веществами, между которыми происходят физические и химические взаимодействия. Компоненты - это вещества, которые образуют раствор.
Один из компонентов раствора - растворитель, другой - растворенное вещество (рис. 51).
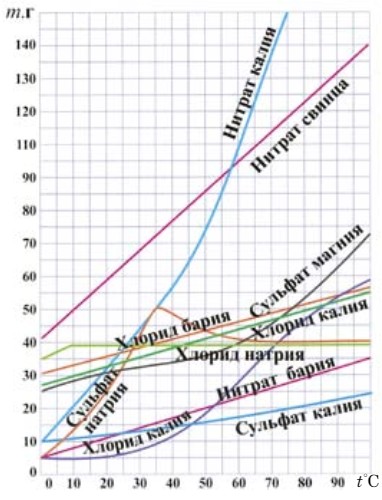
При растворении веществ образуются насыщенные, ненасыщенные и перенасыщенные растворы. Раствор, который содержит максимальное количество растворенного вещества при данной температуре, называется насыщенным. В ненасыщенном растворе растворенного вещества содержится меньше, чем в насыщенном при данной температуре. А в перенасыщенном растворе растворенного вещества содержится больше, чем в насыщенном при данной температуре. Количественной характеристикой растворимости является коэффициент растворимости.
Коэффициент растворимости (S) показывает, какая максимальная масса вещества может раствориться в 100 г (1000 г) воды при данной температуре (рис. 52). Растворимость в воде выражается в граммах вещества на 100
или 1000 г воды (г/100 г Н2О).
Лабораторный опыт № 5
«Изучение растворимости веществ».
Цель: исследовать растворимость различных веществ в воде.
| Реактивы | Оборудование, посуда |
| 1. Свежеприготовленный Са(ОН)2. 2. Хлорид кальция СаС12 (крист). 3. Карбонат кальция СаСО3 (крист) | Химические стаканыСтеклянные палочкиДистиллированная водаМерные цилиндры |
Ход работы
- В три химических стакана налейте с помощью цилиндра определенный объем дистиллированной воды.
- Испытайте растворимость трех веществ: Са(ОН)2, СаСl2, СаСО3 в воде, перемешивая стеклянными палочками.
Вопросы и задания
- Сравните свои наблюдения по растворимости с табличными данными в конце учебника.
- Влияние какого фактора на растворимость вы исследовали на данном опыте?
Практическая работа №4
Влияние температуры на растворимость твердых веществ
Цель: уметь рассчитывать растворимость вещества на 100 г воды, используя технику выпаривания, сравнивать полученные результаты со справочными данными.
| Реагенты | Оборудование, посуда |
| Кристаллы соли К2Сr2О7 — бихромат калия, дистиллированная вода | Часовое стекло, стакан на 50 мл, термометр, электрическая плитка, асбестиро- ванная сетка, технические весы, стеклянная палочка, нить от шерстяной пряжи |

Ход работы
- Взвесьте на технических весах 10 г К2Сr2О7.
- Налейте 20 мл дистиллированной воды в стакан, насыпьте соль, измерьте температуру.
- Поставьте на асбестированную сетку и нагрейте до полного растворения, измерьте температуру.
- Привяжите на стеклянную палочку нить и подвесьте над стаканом и охладите до комнатной температуры. Следите, чтобы нить висела вертикально посередине стакана.

Вопросы и задания
- Какие растворы называются ненасыщенными, насыщенными и перенасыщенными?
- Как повлияло на растворимость данной соли повышение температуры?
- Что такое растворимость?
- После охлаждения раствора до комнатной температуры понаблюдайте, что просходит с нитью, которая висит посередине стакана? Какие кристаллы образуются?
