Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 21
§41. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ ВЕЩЕСТВА В РАСТВОРЕ
Второй способ выражения концентрации - молярная концентрация.
Молярной концентрацией раствора (С) называется число молей растворенного вещества в одном литре раствора.
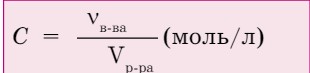
Преобразуя эту формулу, получим следующую формулу:
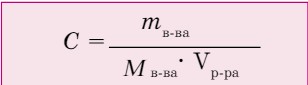
Молярная концентрация более точна, чем массовая доля растворенного вещества.
Растворы веществ с определенной молярной концентрацией готовят в специальной посуде (мерных колбах).
По формуле можно определить следующие величины:

Расчет молярной концентрации раствора.
Задача 1. Рассчитать молярную концентрацию раствора гидроксида натрия, если 0,8 г вещества растворено в 100 мл раствора.


Расчет массы вещества, необходимой для приготовления раствора.
Задача 3. Сколько граммов гидроксида калия потребуется для приготовления 250 мл раствора концентрацией 0,1 моль/л?

1. Рассчитайте объем 0,5 молярного раствора, приготовленного из 5,05 г нитрата калия (КNО3).
Ответ: 100 мл.
2. Сколько граммов гидроксида натрия содержится в 500 мл раствора концентрацией 0,1 моль/л?
Ответ: 2 г.
В
- Сколько моль Nа2СО3 • 10Н2О необходимо для приготовления 200 мл раствора соды Nа2СО3 концентрацией 0,3 моль/л. Рассчитайте массу соды в граммах.
Ответ: 0,06 моль, 17,16 г.
- Из мерной колбы с раствором серной кислоты концентрацией 0,1 моль/л, отобрано пипеткой 20 мл раствора. Рассчитайте число молекул серной кислоты в пипетке.
Ответ: 1,204 • 1021.
C
- Какая масса гидроксида натрия потребуется для полной нейтрализации 25 мл раствора фосфорной кислоты концентрацией 0,25 моль/л?
Ответ: 0,75 г.
- Сколько граммов вещества содержится в 1 мл раствора серной кислоты концентрацией 0,5 моль/л?
Ответ: 0,049 г.
Практическая работа №5
Приготовление растворов с заданной процентной и молярной концентрацией
| Реактивы | Оборудование, посуда |
| Сахар (песок) — С12Н22О11, поваренная соль — NаСl, дистиллированная вода | Стакан на 250 мл, мерная колба на 50 мл, стеклянная палочка, технические и электронные весы, цилиндр, ареометр |
Опыт 1
Задание
Приготовить 150 г 5%-ного раствора сахара.
Ход работы
- Вычислите, какая масса сахара потребуется для приготовления данного раствора.
- Взвесьте эту массу на технических весах в предварительно взвешенном на технических весах стаканчике.
- Рассчитайте объем воды для растворения взятой навески.
- Отмерьте мерным цилиндром этот объем воды.
- Вылейте воду в стакан, растворите в ней сахар, перемешивая раствор стеклянной палочкой.
Опыт 2
Задание
Приготовить 250 мл 0,25 молярного раствора поваренной соли.
Ход работы
- Рассчитайте, какая масса поваренной соли потребуется для приготовления 250 мл 0,25 молярного раствора соли.
- На предварительно взвешенном часовом стекле взвесьте рассчитанную в п. 1 массу соли на электронных весах.
- Взятую взвешанную массу соли всыпьте через воронку в мерную колбу емкостью 250 мл и тщательно смойте дистиллированной водой с воронки оставшуюся на ней соль.
- Долейте в колбу воду до метки, закройте пробкой и хорошо перемешайте.
- Вылейте раствор в сухой цилиндр (узкий) и определите плотность.
Вопросы и задания
- Какая концентрация более точная? Почему?
- Как вы считаете, может ли плотность водного раствора быть меньше плотности воды?
ТИПОВЫЕ ЗАДАЧИ ПО ТЕМЕ «КОНЦЕНТРАЦИЯ РАСТВОРОВ»
Массовые доли растворенного вещества
- Расчет массы вещества и массы растворителя, необходимых для приготовления раствора определенной концентрации.
Сколько граммов соли и воды потребуется для приготовления 300 г 35%-ного раствора?

- Расчет массы (объема) раствора по известной концентрации раствора и по массе растворенного вещества.
Какой объем 14,3%-ного раствора можно приготовить из 30 г сульфата натрия? (р = 1,13 г/мл)


- Расчет массы растворенного вещества по известной массе растворителя и концентрации раствора.
Сколько вещества нужно растворить в 250 мл воды для приготовления раствора с концентрацией 12%?


РАСЧЕТНЫЕ ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ С ИСПОЛЬЗОВАНИЕМ КОНЦЕНТРАЦИИ РАСТВОРА
Раствор - смесь, состоящая по крайней мере из двух компонентов - растворенное вещество, растворитель. Поэтому при решении задач по уравнению реакции необходимо рассчитать массу чистого вещества в растворе.
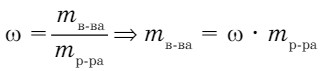
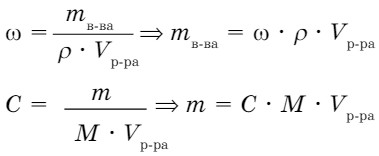
Задача 1
Рассчитать объем (н. у.) и количество вещества водорода по реакции взаимодействия цинка с 12%-ным раствором серной кислоты (p = 1,083 г/мл) объемом 50 мл.

Задача 2
Рассчитать объем раствора гидроксида натрия с концентрацией 0,25 моль/л, необходимого для нейтрализации 20%-ной (p = 1,12 г/мл) азотной кислоты объемом 25 мл. Сколько нитрата натрия образуется?


СПОСОБЫ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
Существует несколько способов изменения концентрации раствора: смешение двух растворов с известными концентрациями, разбавление или сгущение путем выпаривания и добавления растворенного вещества.
А. Определение концентрации раствора, полученного смешением двух растворов с известными концентрациями.
Какова концентрация раствора, полученного смешением 400 г 10%- ного и 300 г 25%-ного растворов?


- Определение концентрации раствора после разбавления.
В лабораториях растворы нужной концентрации готовят путем разбавления концентрированных растворов.
К 500 г 15%-ного раствора соли добавили 200 г воды. Определите процентную концентрацию полученного раствора.

- Определение концентрации после увеличения массы растворенного вещества в растворе.
Концентрацию раствора можно повысить двумя способами:
- добавлением растворенного вещества;
- испарением части растворителя (Н2О).
а) Определите концентрацию раствора после добавления 30 г вещества к 250 г 5%-ного раствора.


А
- Рассчитайте концентрацию раствора после разбавления, если к 300 мл воды долито при перемешивании 500 мл 30%-ного раствора (р = 1,149 г/мл) соляной кислоты.
Ответ: 19,7%.
- Сколько граммов медного купороса CuSO4 • 5H2O требуется для приготовления 500 мл 0,2 молярного раствора сульфата меди (II).
Ответ: 25 г CuSO4 • 5H2O.
- Рассчитать, какой объем соляной кислоты концентрацией 0,05 моль/л необходим для нейтрализации 10 мл раствора гидроксида калия концентрацией 0,15 моль/л.
Ответ: 30 мл.
В
- Врачи вводят под кожу или в вену больного так называемый физиологический раствор — 0,85%-ный раствор хлорида натрия. Рассчитайте массу соли при введении 250 мл (р = 1,003 г/мл) физиологического раствора.
Ответ: 2,13 г.
- Рассчитайте массу глюкозы (С6Н12О6) в 5 л крови человека (р = 1,05 г/мл), если содержание глюкозы в крови составляет 0,1%.
Ответ: 5,25 г.
- При засолке огурцов в трехлитровую банку заливают рассол объемом 950 мл и добавляют 3 столовых ложки поваренной соли (в 1 столовой ложке помещается 30 г соли). Определите массовую долю поваренной соли в приготовленном рассоле.
Ответ: 8,65%.
С
- Рассчитайте процентную концентрацию насыщенного раствора нитрата бария при температуре 70°С, если растворимость этой соли составляет 20 г/100 г воды.
Ответ: 16,67%.
- Определите массовую долю и растворимость поваренной соли, если при температуре 15°С в 274 г насыщенного раствора содержится 74 г NaCl.
Ответ: 27%, 37 г/100 г Н2О.
- Рассчитайте концентрацию полученного раствора при смешении 500 мл 23%- ного раствора (р = 1,3 г/мл) и 200 мл 42%-ного раствора (р = 1,7 г/мл).
Ответ: 29,53%.
Знаешь ли ты?
Вещество состоит из двух элементов, один из них горит, а другой поддерживает горение. Полученное вещество гасит огонь, что это за вещество?
Словарь по темам «Растворимость и растворы»
| № | Русский | Казахский | Английский |
| 1. | растворитель | еріткіш | solvent |
| 2. | растворенное вещество | еріген зат | solute |
| 3. | раствор | ерітінді | solution (solvent) |
| 4 | растворимость | ерігіштік | solubility |
| 5 | концентрация растворов | ерітінді концентрация | concentration of solutions |
| 6 | массовая доля растворенного вещества | еріген заттың массалық үлесі | solute's mass fraction |
| 7 | молярная концентрация растворов | ерітіндінің молярлы концентрациясы | molar concentration |
ДЕЛАЕМ ВЫВОДЫ
- Растворы - однородные системы, состоящие из растворенного вещества и растворителя.
- Вещества характеризуются растворимостью.
- Растворимость зависит от агрегатного состояния вещества, температуры и давления (для газообразных веществ).
- Концентрация растворов выражается массовой долей растворенного вещества и молярной концентрацией.
Глава XI. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ГЕНЕТИЧЕСКАЯ СВЯЗЬ
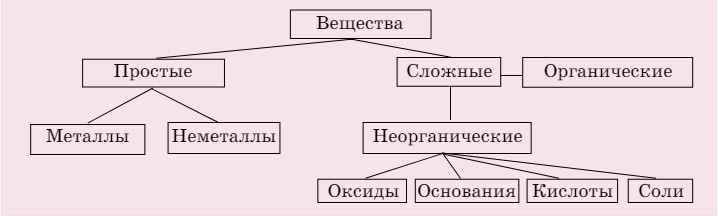
Эта глава посвящена основным классам неорганических веществ. Вещества, имеющие сходный состав и свойства, объединяются в единый класс соединений. Классификация веществ приведена в схеме 1.
Горение, кислород, воздух
Схема 1. Классификация веществ
§42. ОКСИДЫ
Горение, кислород, воздух
Рассмотрим подробно большой класс сложных веществ - оксиды.
Оксиды - вещества, состоящие из атомов двух элементов, одним из которых является кислород. Оксиды подразделяются на несолеобразующие и солеобразующие (схема 2), а солеобразующие, в свою очередь, делятся на кислотные, основные и амфотерные.
Схема 2. Классификация оксидов
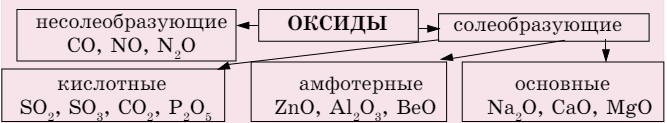
Кислотным оксидам соответствуют кислоты P2O5 → H3PO4; SO3 → H2SO4; основным оксидам - основания: Na2O → NaOH; CaO → Ca(OH)2. А амфотерным оксидам соответствуют и кислоты, и основания:
H2ZnO2 ← ZnO → Zn(OH)2
К кислотным оксидам относятся оксиды неметаллов, к основным оксидам - оксиды металлов. А к амфотерным оксидам относятся оксиды, проявляющие общие свойства оксидов - взаимодействие и с кислотами, и с щелочами.
Химические формулы, в которых указан порядок соединения атомов в молекулах, называются графическими формулами. В этих формулах каждойчерточке соответствует единица валентности элемента.
Графические формулы оксидов.
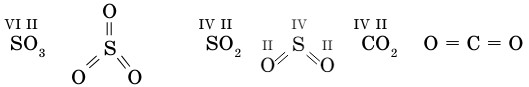
Если число атомов оксидообразующего элемента четное, то один из атомов кислорода соединяет эти атомы:
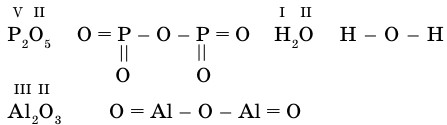
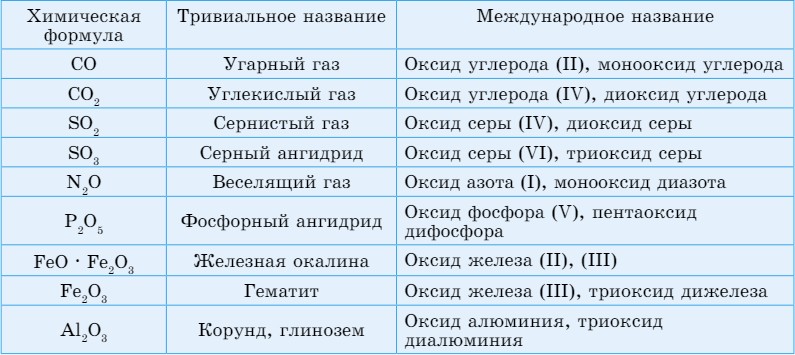
Номенклатура оксидов. Для некоторых оксидов существуют исторически сложившиеся (тривиальные) названия: Аl2О3 - глинозем, корунд, SiO2 - кремнезем.
Международная номенклатура оксидов приведена в таблице 22.
Таблица 22. Названия некоторых оксидов
Физические свойства. Оксиды могут существовать в трех агрегатных состояниях:
CuO, CaO, Fe2O3, P2O5 - твердые вещества;

Запомни!
Оксид фосфора (V) очень хорошо впитывает влагу. Это свойство проявляется у него в 30 000 раз сильнее, чем у хлорида кальция и в 300 раз сильнее, чем у концентрированной серной кислоты. Оксид фосфора (V) может даже кислоты перевести в ангидриды:
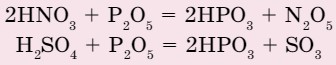
А
- Установите соответствие между приведенными ниже химическими формулами оксидов и их названиями:

- Составьте графические формулы оксидов титана (II, III, IV).
- Сколько молей составляют 17,6 г углекислого газа?
- Определите объем 2,5 молей газа NO (при н. у.)?
В
- В какой массе образца оксида алюминия содержится столько же структурных единиц, сколько в 100 г воды?
Ответ: 566,7 г Al2O3.
- Рассчитайте массу кислорода в 500 г оксида железа (III).
- Рассчитайте массу серной кислоты, необходимой для растворения 16 г оксида меди (II). (H2SO4 + CuO → CuSO4 + H2O).
- Составьте формулы оксидов, если отношения масс элементов в них следующие:

C
- Определите формулы оксидов, соответствующих следующим соединениям: Н3ВО3, Мn(ОН)2, Н2СrО4, Сr(ОН)3, НСlО4, Fе(ОН)2, Н2SiO3, КОН.
- Оксид четырехвалентного элемента содержит 13,39% кислорода. Определите этот элемент.
- Рассчитайте объем 20% -ного раствора гидроксида натрия (р = 1,225 г/мл), который может вступать в реакцию с 8,96 л (н. у.) оксида серы (IV) по следующей схеме:
NаОН + SО2→ Nа2SО3 + Н2О.
Ответ: 130,6 мл.
- Одинаковое ли количество кислорода можно получить при разложении:
- одного моля оксида серебра (I) и одного моля оксида ртути (II);
- одного грамма оксида серебра (I) и одного грамма оксида ртути (II)?
