Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 22
§43. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Свойства оксидов зависят от того, оксидом какого элемента является данное вещество.
Химические свойства кислотных оксидов.
- Большинство кислотных оксидов взаимодействуют с водой, образуя кислоты:
Р2О5 + 3Н2О = 2Н3РО4
SO2 + Н2О = н2Sо3
СО2 + Н2О = Н2СО3
Если продувать углекислый газ через воду, в которую добавлен раствор синего лакмуса, то раствор постепенно приобретает красный цвет. Это свидетельствует о том, что образовалась, хотя и неустойчивая, угольная кислота. Оксид кремния не растворим в воде, поэтому нерастворимую в воде кремниевую кислоту получают другими способами.
Вывод:
кислотный оксид + вода = кислота
- Кислотные оксиды взаимодействуют с основными оксидами, образуя соли:
CO2 + CaO = CaCO3
P2O5 + 3Na2O = 2Na3PO4
Вывод:
кислотный оксид + основной оксид = соль
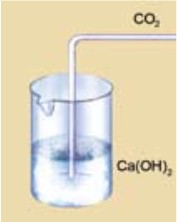
- Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду (рис. 57).
СО2 + Са(ОН)2 = СаСО3 ↓ + Н2О
SО3 + Ва(ОН)2 = ВаSО4 ↓ + Н2О
Вывод:
кислотный оксид + растворимое основание = соль + вода
Химические свойства основных оксидов.
- Оксиды активных металлов при взаимодействии с водой образуют щелочи:
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Если подействовать на негашеную известь (СаО) водой, то сразу начнется реакция с выделением тепла. При добавлении к образовавшемуся раствору капли раствора фенолфталеина появляется малиновая окраска.
Вывод:
оксид активного металла + вода = щелочь
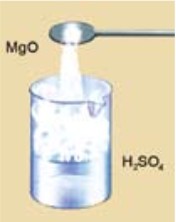
- При взаимодействии основных оксидов с кислотами образуются соль и вода (рис. 58):
CaO + 2HCl = CaCl2 + H2O
MgO + H2SO4 = MgSO4 + H2O
основной оксид + кислота = соль + вода
Химические свойства амфотерных оксидов.
Амфотерные оксиды являются твердыми веществами.
При взаимодействии с кислотами они проявляют свойства основных оксидов:
ZnO + 2HCl = ZnCl2 + H2O
амфотерный оксид + растворимая кислота → соль + вода
При взаимодействии со щелочами проявляют свойства кислотных оксидов, образуя соль и воду.
ZnO + 2NaOH = Na2ZnO2 + H2O
амфотерный оксид + щелочь → соль + вода
Для того чтобы написать формулу соли, к формуле оксида мысленно добавим молекулу воды (ZnO + H2O = H2ZnO2), тогда получим формулу соответствующей кислоты. В результате реакции образуется соль этой кислоты.
Запомни!
Почему мы зеваем? Кто-то ответит, что мы заполняем легкие кислородом воздуха. Это неправильный ответ. В действительности, когда количество углекислого газа в крови увеличено, мы начинаем зевать, чтобы избавиться от СО2.
А
- Классифицируйте следующие оксиды: Na2O, CO2, CaO, SiO2, ZnO, SO3, Al2O3, N2O5.
- Составьте формулы продуктов взаимодействия с водой: SO3, CaO.
- Какие из данных веществ вступают во взаимодействие с оксидом кальция: H2SO4, CuO, CO2, Na, CuCl2, NaOH? Напишите уравнения возможных реакций.
- Составьте графические формулы оксидов: фосфора (III), фосфора (V), железа (II), железа (III), диоксида углерода.
- Как можно определить, является ли растворимый в воде оксид основным или кислотным?
В
- Закончите уравнения следующих реакций:

- Напишите формулы продуктов сгорания следующих веществ: C3H8, P, S, Mg, NO, SO2.
- Напишите формулы оксидов, соответствующих следующим гидроксидам: Cr(OH)3, Pb(OH)2, LiOH.
- В какой массе триоксида серы содержится столько же серы, сколько в 3,2 г диоксида серы?
Ответ : 4 г.
- Каждому основанию соответствует основной оксид - оксид металла. Можно ли сказать, что всякому оксиду металла соответствует основание?
- Подготовьте презентацию по теме «Оксиды».
С
- Закончите следующие уравнения реакций, подберите нужные коэффициенты:

- Рассчитайте объем 30%-ного гидроксида натрия (р =1,332 г/мл), необходимого для растворения 20,4 г оксида алюминия, уравнение реакции:
Аl2О3 + 6NaOH = 2Na3AlO3 + 3Н2О
Ответ: 120,1 мл.
- Заполните таблицу знаками «+» или «-», отметьте химические свойства предложенных оксидов.
| Формула оксида | Классификация | Соответствующие гидроксиды | Химические свойства | ||||
| с водой | с кислотами | с основаниями | с оксидами | ||||
| кислотными | основными | ||||||
| CaO | |||||||
| SO2 | |||||||
| ZnO | |||||||
| Na2O | |||||||
| Al2O3 | |||||||
| P2O5 | |||||||
Запишите уравнения соответствующих реакций в тетради.
Лабораторный опыт №6
Изучение свойств оксидов
Цель: знать и понимать классификацию и свойства оксидов.
| Реактивы | Оборудование, посуда |
| Негашеная известь (CaO), красный фосфор, индикаторы, вода дистиллированная | Фарфоровая чашка, пробирки, железная ложка, спиртовка, коническая колба, спички |
Взаимодействие воды с оксидами
а) с оксидом кальция:
Положите в фарфоровую чашку кусочек негашеной извести и осторожно залейте водой. Происходит ли реакция? Дайте отстояться, затем слейте раствор, разделив его на две пробирки, испытайте индикаторами. Дайте объяснение наблюдаемым явлениям. Напишите уравнение реакции.
а) с оксидом фосфора (V):
Набрав немного красного фосфора железной ложкой, держите на пламени спиртовки. Как только фосфор загорится, перенесите в коническую колбу. Колба заполнится белым дымом оксида фосфора. Налейте немного дистиллированной воды и перемешайте. Испытайте индикаторами. Напишите уравнение реакции.
ДЕЛАЕМ ВЫВОДЫ
- Оксиды - это вещества, состоящие из атомов двух элементов, одним из которых является кислород.
- Оксиды делятся на основные, кислотные и амфотерные.
- Оксиды типичных металлов относятся к основным, а неметаллов - к кислотным, оксиды некоторых металлов относятся к амфотерным.
- Основные оксиды вступают во взаимодействие с кислотными и амфотерными оксидами, а также с кислотами.
- Кислотные оксиды вступают в реакции с основными, амфотерными оксидами, а также со щелочами.
- Оксиды металлов группы 1-11 А вступают в реакции с водой, а также с растворимыми в воде оксидами неметаллов.
§44. КИСЛОТЫ
Перейдем теперь к изучению нового класса соединений - кислот.
В повседневной жизни вам не раз приходилось слышать о кислотах, к примеру об уксусной кислоте, которую применяют при консервировании овощей. Кислый вкус недозрелых яблок, лимона, щавеля, кумыса и кефира обусловлен наличием в их составе различных кислот (рис. 59).
Соляную и серную кислоты получают промышленным способом.
Кислоты — сложные вещества, имеющие в своем составе атомы водорода, способные замещаться на атомы металла и кислотные остатки.

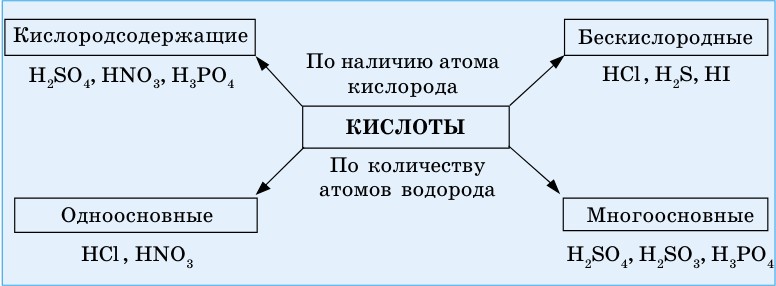
Как вы видите из схемы 3, кислоты по наличию в их составе кислорода подразделяются на кислородсодержащие и бескислородные. По числу атомов водорода — на одноосновные и многоосновные.
Азотная (HNO3), соляная (HCl) и серная (H2SO4) кислоты - жидкие вещества, а фосфорная (H3PO4) и борная (H3BO3) кислоты - твердые. Кремниевая (H2SiO3) кислота - нерастворимое в воде соединение, а угольная H2CO3 и сернистая (H2SO3) - неустойчивые, легко разлагающиеся вещества.
Для определения принадлежности вещества к кислотам или основаниям применяются индикаторы. Например, фиолетовый лакмус в кислой среде краснеет, в щелочной - синеет, а в нейтральной - остается фиолетовым. Метилоранж в кислой среде становится розовым.
В кислоте и соответствующем ей оксиде заряд кислотообразующего элемента должен быть одинаковый.
Например, в фосфорной кислоте (H3PO4) заряд фосфора +5.
+1 х -2
H3PO4 :
По методу «нулевой суммы»:
+ 1 • 3 + х + 4(-2) = 0
х = +5
Заряд фосфора соответствует валентности элемента фосфора.
Следовательно, этой кислоте соответствует оксид фосфора (V) P2O5.
Для вывода формул кислот по формулам оксидов можно мысленно (так как не все оксиды вступают в реакцию с водой) сложить формулы оксидов и воды.
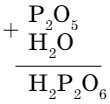
Получим формулу, в которой все индексы четные, поэтому их можно сократить на 2. Н2Р2О6 : 2 = НРО3. К полученной формуле метафосфорной кислоты добавим еще одну молекулу воды:
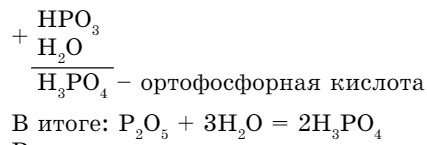
Рассмотрим другие примеры вывода формул кислот, когда известны формулы соответствующих им оксидов:
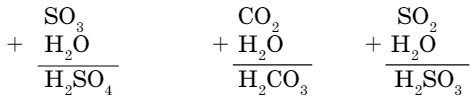
Оксиды, соответствующие кислотам, называются кислотными.
Кислоты состоят из атомов водорода и кислотных остатков. Как можно определить валентность кислотных остатков? В соляной кислоте хлор связан с одним атомом водорода, который замещается на металл при взаимодействии кислоты с металлом 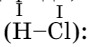

В ходе химических реакций кислотные остатки сохраняются.
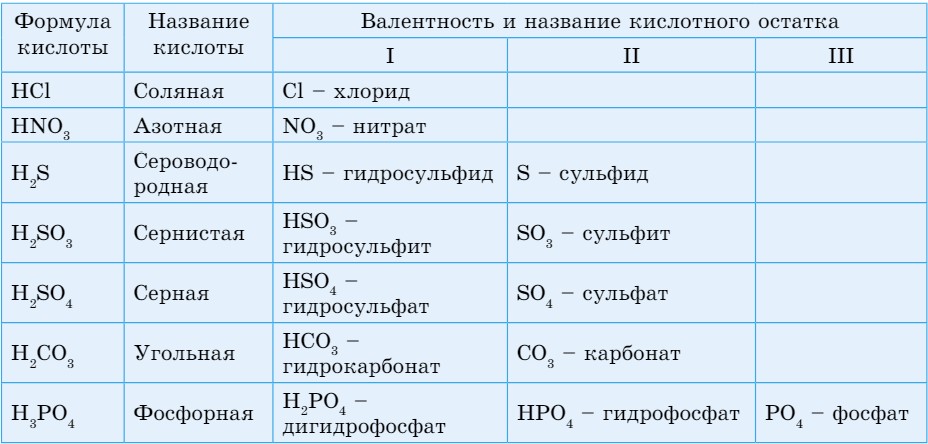
Номенклатура кислот. Если кислотообразующий элемент проявляет переменную валентность, то название кислоты, соответствующей промежуточной валентности элемента, образуется от названия элемента с помощью суффикса -ист и окончания -ая (табл. 23).

Название кислоты, соответствующей высшей валентности кислотообразующего элемента, образуется от названия элемента с помощью суффикса -н- и окончания -ая,
HNO3 — азотная
H2SO4 — серная
H3PO4 — фосфорная
HClO4 — хлорная
Некоторые кислоты имеют как исторические названия, так и международные. Например, HCl — соляная кислота (хлороводородная), HF - плавиковая (фтороводородная), H2CO3 - угольная (карбонат водорода), H3PO4 — фосфорная (тетраоксотригидрофосфат, число атомов элементов указывается греческими числительными).
Таблица 23. Названия кислот и валентность кислотных остатков
Графические формулы кислот.
Составление графических формул кислот начинается с написания знака водорода, так как он одновалентен: Н - Сl, Н - S — Н. Как видно из формул, в бескислородных кислотах атом водорода непосредственно связывается с кислотообразующим элементом. А в кислородсодержащих кислотах водород соединяется с кислотообразующим элементом посредством атома кислорода:
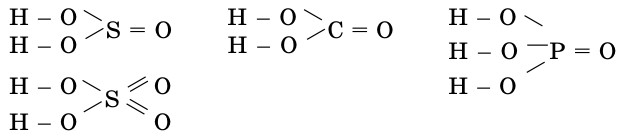
А
- Определите валентность кислотных остатков угольной и сероводородной кислот.
- Напишите формулы соответствующих оксидов угольной и азотной кислот. Напишите уравнения реакций образования этих кислот.
- Допишите схемы уравнений реакций и расставьте коэффициенты:
? + Н2О → НNО2
? + Н2О → Н3РО3
? + Вr2 → НВr
- Напишите формулы оксидов, соответствующих следующим кислотам: НСlО, Н3РО3, Н2СrО4, Н2МnО4, НМnО4, Н2СО3.
В
- Напишите уравнения реакций взаимодействия натрия с серной и фосфорной кислотами, если реакции идут с постепенным замещением атомов водорода в кислоте на металл.
- Сколько граммов серной кислоты вступает в реакцию с 48 г магния?
Ответ: 196 г.
3. При взаимодействии цинка с соляной кислотой выделилось 67,2 л водорода (н. у.). Определите массу кислоты, вступившей в реакцию.
Ответ : 219 г.
4. Укажите ряд, в котором расположены кислоты, где валентность кислотообразующего элемента равна пяти:
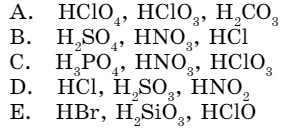
C
- Напишите формулы кислот, соответствующих следующим оксидам: N2O3, N2O5, Cl2O7.
- Сколько хлора и водорода (м3) при нормальных условиях необходимо для получения 10 м3 хлороводорода?
- Составьте формулы кислот, если соотношения масс элементов в них таковы:
a) m(H) : m(P) : m(O) = 3 : 31 : 48;
6) m(H) : m(P) : m (O) = 3 : 31 : 64.
4. Заполните таблицу:
| Формула кислоты | Название кислоты | Валентность кислотного остатка | Валентность кислотообразующего элемента | Формулы соответствующих оксидов |
| HClO4 | ||||
| HMnO4 | ||||
| H2CO3 | ||||
| H2SiO3 | ||||
| H3PO4 |
