Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 23
§45. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Химические свойства кислот. Кислоты составляют одну группу сложных веществ и обладают общими характерными для них свойствами.

- Взаимодействие кислот с металлами. В соответствии с определением, кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Вспомните, как кислоты взаимодействуют с металлами (§12).
Mg + 2HCl = MgCl2 + H2↑
кислота + металл = соль + водород
- Взаимодействие кислот с оксидами металлов. Поместим в пробирку оксид кальция, добавим раствор соляной кислоты, при этом образуется соль хлорид кальция и вода:
CaO + 2HCl → CaCl2 + H2O
С оксидом меди (II) образуется зеленоватый раствор хлорида меди (II) и вода:
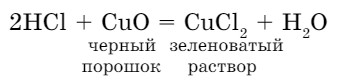
кислота + основной оксид = соль + вода
Кислоты вступают в реакции с амфотерным оксидом и образуют соль и воду: 6HCl + Al2O3 = 2AlCl3 + 3H2O
кислота + амфотерный оксид — соль + вода
- Кислоты взаимодействуют с растворимыми и нерастворимыми основаниями:
HCl + NaOH = NaCl + H2O 2HCl + Cu(OH)2 = CuCl2 + 2H2O Кислоты, взаимодействуя с основаниями, образуют соль и воду. Общая схема:
кислота + основание = соль + вода
4. Кислоты вступают в реакции обмена с солями и образуют кислоту:
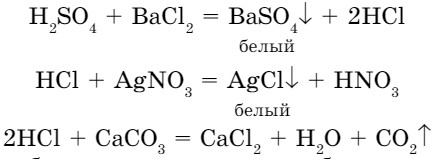
Кислоты с солями образуют осадок или с карбонатами образуют углекислый газ (СО2).
- Некоторые нерастворимые кислоты при нагревании разлагаются:
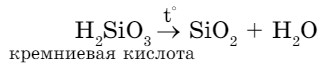
Кислоты — серная, азотная, соляная, уксусная — очень едкие. Они разъедают даже самые стойкие металлы. Некоторые кислоты безвредны: вкус лимонов и апельсинов. Молочная кислота образуется, когда скисает молоко.
А
- Как классифицируются кислоты?
- Даны следующие кислоты: соляная HCl, фтористоводородная HF, фосфорная H3PO4, угольная H2CO3, кремниевая H2SiO3, мышьяковистая H3AsO3. Укажите, какие из этих кислот являются одноосновными, какие — двухосновными и какие — трехосновными.
- С помощью каких индикаторов определяют кислоты?
- Определите валентности кислотообразующих элементов в кислотах, перечисленных в задании 2.
- Приведите в соответствие названия и формулы кислот:
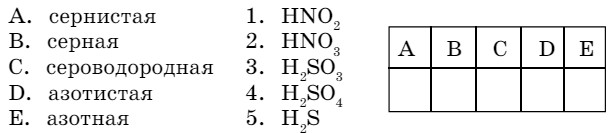
B
- С какими из данных веществ вступает в реакцию серная кислота: NaOH, H3PO4, CO2, Au, FeS, MgO, Fe? Составьте уравнения возможных реакций.
- Составьте графические формулы следующих кислот: бромоводородная HBr, угольная H2CO3, фосфористая H3PO3, азотистая HNO2, йодоводородная HI, сернистая H2SO3.
- Напишите формулы кислот, соответствующие следующим оксидам: CO2,SO3, P2O5, N2O3.
- Составьте формулы оксидов, соответствующих следующим кислотам: HClO, H2SO4, HNO3, HMnO4.
C
- Закончите уравнения реакций:

- Составьте формулу кислоты по соотношению масс элементов:
m (H) : m (C) : m (O) = 1 : 6 : 24
- Какой объем (н. у.) углекислого газа выделится при взаимодействии 500 г 30%-ной соляной кислоты с карбонатом кальция?
Ответ: 46,03 л CO2.
- Определите объем 25,8%-ного гидроксида натрия (р =1,285 г/мл), необходимого для нейтрализации 300 г 20%-ного раствора серной кислоты.
Ответ: 147,74 мл.
Лабораторный опыт №7
Изучение свойств кислот
Цель: знать и понимать состав и свойства кислот.

Опыт 1. Действие индикаторов на растворы кислоты.
Налейте в три пробирки по 3—5 мл дистиллированной воды и добавьте в каждую по две капли индикатора: в первую пробирку — лакмуса, во вторую — метилоранжа и в третью — фенолфталеина. Затем в каждую пробирку добавьте раствор фосфорной кислоты. Пронаблюдайте за изменением окраски и заполните следующую таблицу.
Действие индикаторов на растворы кислот
| Среда | Цвет индикатора | ||
| Фенолфталеин | Метилоранж | Лакмус | |
| Нейтральная | |||
| Кислая | |||
Обратите внимание на физические свойства (цвет, запах, растворимость) кислоты.
Опыт 2. Действие кислоты на металлы.
Налейте в три пробирки раствор фосфорной кислоты. В одну из пробирок насыпьте немного порошка магния, во вторую поместите гранулы цинка, а в третью — медные стружки. Что вы наблюдаете?
Обратите внимание на интенсивность протекания реакций. Напишите уравнения реакций. Сделайте соответствующие выводы.
Опыт 3. Действие кислоты на оксиды и гидроксиды металлов.
Возьмите щипцами кусочек ленты магния, сожгите над асбестовой сеткой и соберите продукты горения.
Каков цвет оксида? Внесите часть порошка оксида магния в пробирку с дистиллированной водой, тщательно размешайте стеклянной палочкой и добавьте к раствору несколько капель фенолфталеина. Что наблюдается? К этому раствору долейте раствор фосфорной кислоты. Что происходит?
Во вторую пробирку наберите оставшуюся часть оксида и долейте раствор фосфорной кислоты. Напишите химические уравнения происходящих реакций.
Опыт 4. Действие раствора кислоты на раствор соли.
Наберите в пробирку раствор фосфорной кислоты, затем добавьте раствор нитрата серебра (I) по каплям. Что происходит? Каков цвет и состав осадка? Напишите уравнение реакции.
Кислотные дожди постепенно отравляют озера и реки, угрожая жизни животных и растений, обитающих в водоемах. Поэтому люди стараются уменьшать количество газовых отходов, которые выбрасываются в атмосферу в промышленно развитых странах.
ДЕЛАЕМ ВЫВОДЫ
- Кислоты - сложные вещества, имеющие в своем составе атомы водорода, способные замещаться на атомы металлов, и кислотные остатки.
- Кислоты классифицируются по содержанию атомов водорода на одноосновные и многоосновные, а по содержанию атомов кислорода - на бескислородные и кислородсодержащие.
- Кислоты вступают во взаимодействие с металлами, с основными и амфотерными оксидами, с основаниями и с солями.
- Некоторые кислоты (нерастворимые, неустойчивые кислоты) разлагаются при нагревании.
§46 ОСНОВАНИЯ. СОСТАВ, НОМЕНКЛАТУРА
Какие щелочи вы знаете? Какие мылкие вещества вы встречали в повседневной жизни?
Есть вещества, противоположные по химическим свойствам кислотам. Это основания (рис. 60).
По материалам предыдущих параграфов вам уже известны такие основания, как NаОН - гидроксид натрия, Са(ОН)2 - гидроксид кальция, Мg(ОН)2 - гидроксид магния.
Основаниями называются сложные вещества, состоящие из атомов металлов, связанных с одной или несколькими гидроксильными группами (ОН).
Поскольку гидроксильная группа одновалентна, их число в составе оснований определяется валентностью металлов:

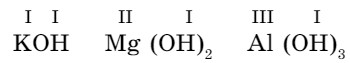
Номенклатура оснований. Названия оснований составляются следующим образом: к слову «гидроксид» добавляется русское название металла в родительном падеже, в скобках римской цифрой указывается переменная валентность.
NaOH - гидроксид натрия
Са(ОН)2 - гидроксид кальция
Fe(OH)2— гидроксид железа (II)
Fe(OH)3 - гидроксид железа (III)
По международной номенклатуре указывается число гидроксильных групп.
Fe(OH)2 - дигидроксид железа
Fe(OH)3— тригидроксид железа
У некоторых оснований сохранились старинные названия, которые связаны с их особыми свойствами или признаками.
NaOH - едкий натр
Са(OH)2 - гашеная известь
Классификация оснований. Физические свойства оснований
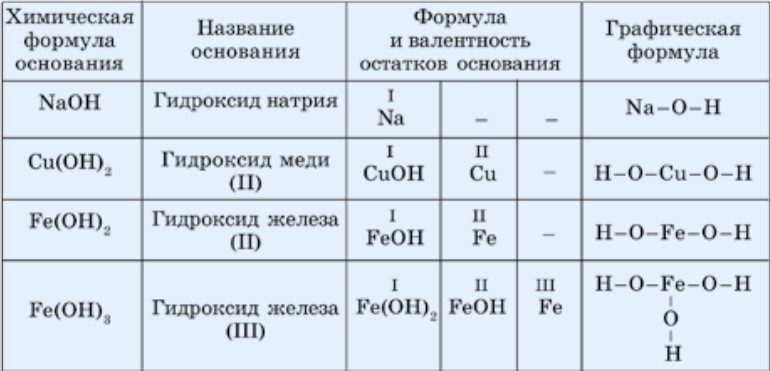
Понятию основность кислот соответствует понятие кислотность оснований . Кислотность определяется числом гидроксильных групп (табл. 24). В химических реакциях гидроксильные группы замещаются на кислотные остатки.
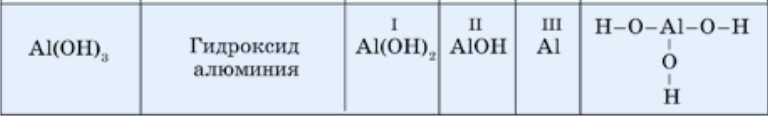
Таблица 24. Химические и графические формулы некоторых оснований
продолжение:
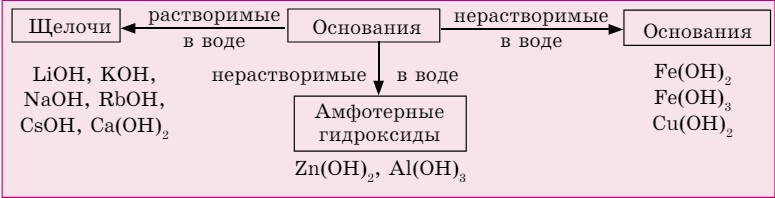
Классификация оснований зависит от их растворимости в воде и химических свойств (схема 4). С помощью индикаторов определяют только растворимые основания — щелочи.
Схема 4. Классификация оснований
Физические свойства. Все основания являются твердыми веществами, свойства которых зависят от их способности растворяться в воде. Чтобы определить, растворимо или нерастворимо основание в воде, используйте таблицу растворимости. Водные растворы щелочей «мылкие» на ощупь, разъедают кожу, бумагу, ткань, поэтому они еще называются едкими щелочами (КОН, NаОН). При работе со щелочами необходимо соблюдать технику безопасности! Щелочи растворяют в фарфоровых кружках, так как стеклянная посуда не выдерживает их действия и быстро разрушается.
С помощью индикаторов определяют растворимые основания — щелочи.
А
- Выпишите из данного ряда формулы оснований: Н2СО3, СuО, SO2, КОН, К2SO4, Nа2СО3, NаОН, Са(ОН)2, СаСО3, СО2, Сu(ОН)2.
- Используя таблицу растворимости, напишите формулы нерастворимых оснований и дайте им названия.
В
- В схемах уравнений химических реакций вместо вопросительного знака вставьте формулы соответствующих веществ, расставьте коэффициенты: ? + NаОН → Cu(ОН)2 + Nа2SO4
Р2О5 + ? → Nа3РО4 + Н2О
Н3РО4 + ? → Са3(РО4)2 + Н2О
C
- Сколько молей соляной кислоты необходимо для растворения 4,9 г гидроксида меди (II)?
Ответ: 0,1 моль.
