Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 24
§47. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Общим свойством оснований является их способность взаимодействовать с кислотами с образованием соли и воды.

- Взаимодействие оснований с кислотами. Нальем немного гидроксида калия в стакан и добавим 1-2 капли индикатора — фенолфталеина. Раствор окрашивается в малиновый цвет. При добавлении в стакан малыми порциями раствора серной кислоты и перемешивании раствор постепенно обесцвечивается, то есть становится нейтральным (рис. 61). Протекает реакция нейтрализации:
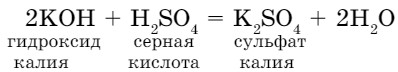
Реакции обмена между кислотами и основаниями называются реакциями нейтрализации.
Нерастворимые в воде основания также взаимодействуют с кислотами:
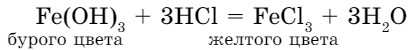
Признаками протекания реакции служат: растворение Fе(ОН)3 бурого цвета и образование раствора FеСl3 желтого цвета. Эти реакции можно выразить схемой:
основание + кислота = соль + вода
Особые свойства растворимых в воде оснований (щелочей).
- Взаимодействие оснований с кислотными оксидами. В пробирку нальем 1 мл известковой воды (раствор гидроксида кальция) и с помощью стеклянной трубки продуем через раствор углекислый газ, который мы выдыхаем. Известковая вода помутнеет, так как углекислый газ вступает во взаимодействие с Са(ОН)2, и образуется карбонат кальция СаСО3, нерастворимый в воде.
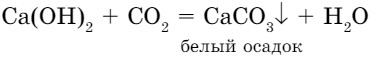
Общая схема взаимодействия щелочей с кислотными оксидами:
щелочь + кислотный оксид = соль + вода
В результате реакции образуется соль той кислоты, которая соответствует кислотному оксиду.

- Щелочи взаимодействуют с растворами солей. В результате реакции один из продуктов выпадает в осадок (рис. 62).
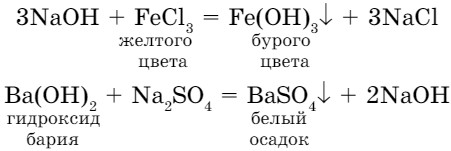
Общая схема взаимодействия щелочи с растворимой солью:
щелочь + растворимая соль = новая соль + новое основание
- Особое свойство нерастворимых в воде оснований - термическое разложение:
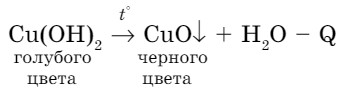
Нерастворимые в воде основания при нагревании разлагаются на соответствующий оксид и воду.
- Свойства амфотерных гидроксидов.
При взаимодействии с кислотами амфотерные основания проявляют свойства оснований, в результате реакции образуются соль и вода:
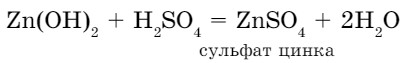
При взаимодействии со щелочами основания проявляют свойства кислот. Тогда формулу основания записываем как формулу кислоты:
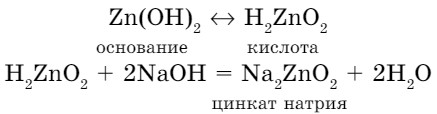
Амфотерный гидроксид + кислота → соль + вода Амфотерный гидроксид + щелочь → соль + вода
A
- С какими из перечисленных веществ будет взаимодействовать гидроксид калия: Ba(NO3)2, CO2, HCl, CuCl2, Cu(OH)2? Напишите соответствующие уравнения реакций.
- Напишите уравнения реакций, соответствующие следующим превращениям:
B
- Напишите уравнения реакций, позволяющие осуществить следующие превращения:
Fe → FeCl2 → Fe(OH)2 → FeO → FeSO4
- Напишите уравнения реакций, характеризующие амфотерные свойства гидроксида алюминия.
- Определите формулы веществ А и В, укажите условия протекания реакций. Напишите уравнения реакций:
Na → А → NaOH → В → CuO → Cu.
С
- Какая масса соли образуется при взаимодействии 200 мл 25%-ного раствора гидроксида натрия (р = 1,285 г/мл) с серной кислотой при полной нейтрализации?
Ответ : 114 г.
- Определите растворимость при температуре 20°C 3,66%-ного насыщенного раствора гидроксида бария.
Ответ : 3,8 г/100 г H2O.
- На нейтрализацию 50 г раствора соляной кислоты израсходовано 4 г едкого натра. Каково процентное содержание HCl в данном растворе?
Ответ : 7,3%.
Лабораторный опыт №8
Изучение химических свойств оснований
Цель : знать и понимать состав и свойства оснований.

Опыт 1. Действие индикаторов на растворы щелочи.
Налейте в три пробирки раствор щелочи и добавьте по каплям растворы индикаторов (фенолфталеин, метилоранж, красный или фиолетовый лакмус). Пронаблюдайте за изменением окраски и заполните таблицу.
| Среда | Индикаторы | ||
| Фенолфталеин | Метилоранж | Лакмус | |
| Щелочная | |||
Опыт 2. Действие щелочи на раствор кислоты.
В пробирку налейте раствор соляной кислоты и добавьте индикатор метилоранж. Затем к этому раствору по каплям из бюретки приливайте раствор щелочи до изменения окраски (до какой окраски?). Напишите уравнение реакции.
Опыт 3. Действие щелочи на раствор соли.
Налейте в пробирку раствор хлорида железа (III) и добавьте по каплям раствор гидроксида натрия. Что происходит? Напишите уравнение реакции.
Закончите уравнения следующих реакций:
- Cu(OH)2 + H2SO4 → ? + ?
- NaOH + MgCl2 → ? + ?
- Ba(OH)2 + CO2 → ? + ?
ДЕЛАЕМ ВЫВОДЫ
- Основаниями называются сложные вещества, состоящие из атома металла, соединенного с одной или несколькими гидроксильными группами.
- Основания делятся по растворимости в воде: на растворимые (щелочи) и нерастворимые. По свойствам - на типичные и амфотерные основания.
- Растворимые основания можно определить с помощью индикаторов.
- Щелочи вступают во взаимодействия с кислотными, амфотерными оксидами и гидроксидами, а также кислотами и растворимыми солями.
- Нерастворимые основания реагируют с кислотами, разлагаются при нагревании.
- Амфотерные гидроксиды вступают во взаимодействие и с кислотами, и с щелочами, при нагревании разлагаются.
§48. СОЛИ: КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА
В этом параграфе мы рассмотрим последний класс неорганических соединений - соли (рис. 63, 64).
Соли - это в основном твердые кристаллические вещества. Важным свойством солей является их растворимость, характеристика которой приводится в специальной таблице растворимости (см. форзац 2 учебника). В таблице растворимые соли обозначены буквой Р, малорастворимые - М, нерастворимые - Н, неустойчивые в воде — «-». Среди солей с хорошей растворимостью отличаются нитраты и соли активных металлов (Nа, К). Практически не растворимы сульфат бария (ВaSО4), карбонат кальция СаСО3, сульфид свинца (PbS) и хлорид серебра (АgCl).
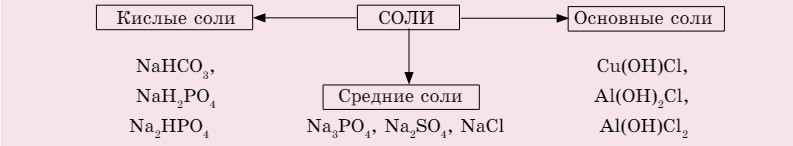
Соли — это сложные вещества, состоящие из атомов металлов и кислотного остатка (схема 5).
- Средние соли образуются при полном замещении атомов водорода в составе кислоты на атомы металлов:
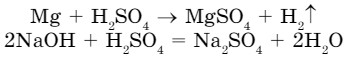
- Кислые соли образуются при неполном замещении атомов водорода в молекулах кислоты на атомы металлов:
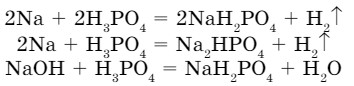


- Основные соли образуются при неполном замещении гидроксогрупп в основаниях на кислотные остатки:
Mg(OH)2 + HCl = Mg(OH)Cl + H2O Al(OH)3 + HCl = Al(OH)2Cl + H2O Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O
Схема 5. Классификация солей
Составление формул солей. Для составления формул солей их рассматривают как бинарные соединения, состоящие из атомов металлов и кислотных остатков.
Составим формулу сульфата натрия: 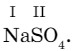
- Находим наименьшее кратное валентностей металла и кислотного остатка: 1 • 2 = 2.
- Наименьшее кратное делится на валентности составляющих:
2 : 1 = 2(Nа); 2 : 2 = 1(SO4).
- Следовательно, формула соли Nа2SО4.
Соли могут образовываться при постепенном замещении атомов водорода в кислотах на атомы металлов.
Как составляются формулы кислых солей?

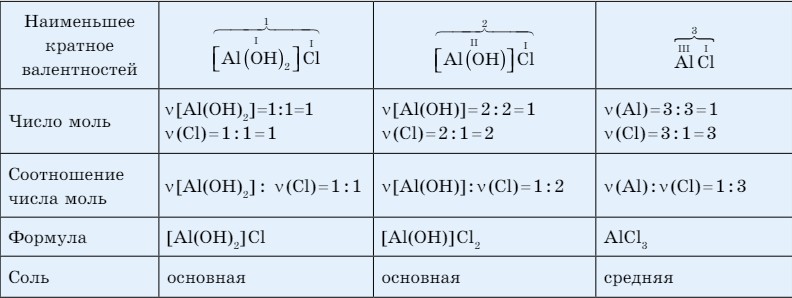
Формулы основных солей составляются аналогично. Их можно рассматривать как продукт постепенного замещения гидроксильных групп в основаниях на кислотные остатки (табл. 26).
Таблица. 26. Алгоритм составления формул солей алюминия
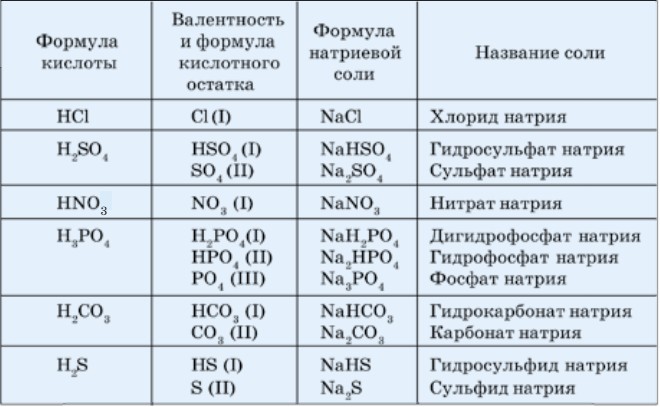
Номенклатура солей. По международной номенклатуре названия солей составляются следующим образом (табл. 27):
- латинское название кислотного остатка;
- название металла в родительном падеже;
- указание валентности металла римскими цифрами в скобках после названия, если металл проявляет переменную валентность в солях.
Названия солей в высшей валентности кислотообразующего элемента оканчиваются на -ат, в низшей валентности - на -ит.
Nа2SО4 — сульфат натрия
Nа2SО3 — сульфит натрия
NаNО3 — нитрат натрия
NаNО2 — нитрит натрия
Названия солей бескислородных кислот оканчиваются на -ид.
Nа2S— сульфид натрия
NаСl — хлорид натрия
В названиях основных солей перед названием кислотного остатка добавляется слово «гидроксо» с указанием числа гидроксильных групп:
СuОНСl — гидроксохлорид меди (II)
Fе(ОН)2Сl - дигидроксохлорид железа (III)
В названиях кислых солей наличие атомов водорода обозначается приставкой гидро- (если 1 атом водорода), дигидро- (если 2 атома водорода). Например, Nа2НРО4 - гидрофосфат натрия, NаН2РО4 - дигидрофосфат натрия.
Таблица 27. Названия и формулы некоторых солей
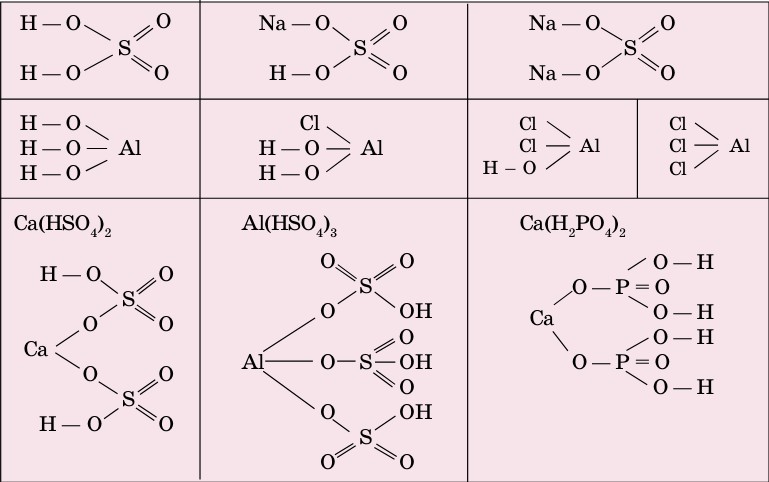
Для того чтобы написать формулы солей, нужно знать графические формулы кислот и оснований (схема 6).
Схема 6. Графические формулы солей
Физические свойства солей. Соли различаются по цвету: РbS, СuS, Аg2S— черного, К2СrО4, РbI2 — желтого, К2Сr2О7 — оранжевого, СdS — красного, СrСl3 — зеленого, СuSО4 - голубого, FеSО4 - светло-зеленого цвета.
Соли в основном - твердые вещества. Чаще всего используют водные растворы солей, поэтому важным свойством солей является их растворимость в воде. Соли обладают различной растворимостью (см. таблицу растворимости).
А
- Напишите формулы следующих солей: гидросульфата натрия, гидросульфата кальция, сульфата кальция, гидрокарбоната кальция, дигидроксохлорида хрома (III), гидроксохлорида алюминия.
- Классифицируйте и назовите следующие соли: Na2CO3, NаНСО3, Аl(ОН)SО4, Аl2(SО4)3, СаНРО4, Са3(РО4)2.
- Составьте графические формулы солей: СuSО4, Аg2S, Nа3РО4, Fе(ОН)SО4, СаНРО4, СаСl2, Сr(ОН)Сl2, Сr(ОН)2Сl.
- Определите массовые доли элементов в сульфате меди (II).
В
- Закончите следующие уравнения, вместо знака впишите соответствующие формулы:
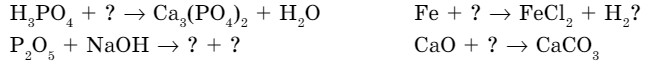
- Классифицируйте следующие соли. Результаты оформите в виде таблицы.
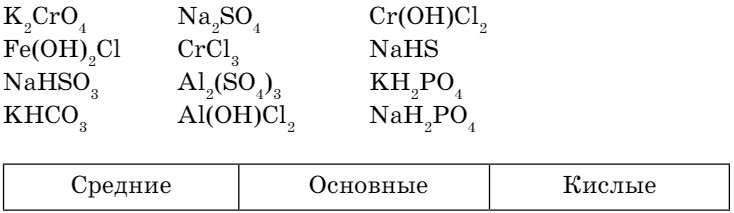
- Какие соли образуются в результате следующих реакций?
Fe(OH)3 + 2HCl → ? + H2O
Fe(OH)3 + 3HCl → ? + H2O
Fe(OH)3 + HCl → ? + H2O
- Как из негашеной извести получить: а) нитрат кальция; б) хлорид кальция? Напишите уравнения реакций.
- При паянии употребляют так называемую травленую кислоту. Получают ее действием цинка на соляную кислоту до прекращения выделения водорода. Напишите уравнение реакции и рассчитайте объем 12%-ной соляной кислоты (р = 1,059 г/мл), которая вступает в реакцию с 13 г Zn, а также массу образовавшейся соли.
Ответ: 27,2 г ZnCl2, 114, 89 мл НСl.
С
- Рассчитайте массу сульфата железа, образующегося в результате реакции железа с 80 г сульфата меди (II).
Ответ: 76 г.
- Определите массу гидрофосфата калия, который образуется в результате взаимодействия 200 мл 40%-ного гидроксида калия (р = 1,424 г/мл) с фосфорной кислотой.
Ответ: 176,98 г.
- Выведите формулу кристаллогидрата сульфата железа (II), если при термическом разложении 13,9 г кристаллогидрата масса уменьшилась на 6,3 г за счет испарения кристаллизационной воды.
- Рассчитайте массу 3%-ного раствора AgNO3, необходимого для получения 2,87 г хлорида серебра.
Ответ: 113,3 г.
- Какие соли образуются в результате следующих реакций: KOH + H2SO4 ч H2O + ? 2KOH + H2SO4 ч 2H2O + ?
Солевой состав крови: 9 г NaCl; 0,42 г KCl; 0,24 г CaCl2; 0,2 г NaHCO3; 1,0 г С6Н12О6 (глюкоза); 1,0 л — Н2О
