Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 25
§49. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
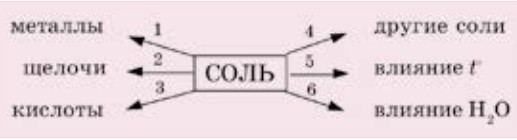
С некоторыми свойствами солей вы уже знакомы. Теперь, чтобы систематизировать ваши знания по данному вопросу, составим следующую схему 7, характеризующую свойства солей:
Схема 7. Свойства солей
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (II) железо вытесняет медь, (рис. 11 а, §9):
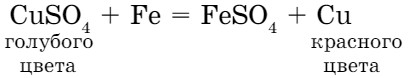
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает (FеSО4 + Сu ≠ ), потому что медь в ряду активности металлов находится после железа. Цинк также вытесняет медь из раствора соли меди, потому что цинк более активный металл, чем медь.
Реакции такого типа протекают при следующих условиях:
- взаимодействующие соли должны быть растворимыми в воде;
- более активный металл вытесняет из соли менее активный металл. Данный металл может вытеснять из растворов солей только те металлы, которые находятся правее его в ряду активности металлов.
металл (1) + соль (1) → металл (2) + соль (2),
где металл (1) более активный, чем металл (2).
Важно отметить, что щелочные и щелочноземельные металлы, взаимодействуя с растворами солей, вытесняют водород из воды, но не вытесняют металлы. Поэтому для выделения металлов из растворов их солей эти металлы использовать нельзя.
- Взаимодействие солей с кислотами.
В сухую пробирку поместим несколько кусочков мрамора и добавим раствор соляной кислоты. Будет протекать следующая реакция:
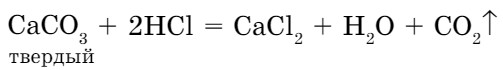
Выделение газа (СО2) является признаком реакции.
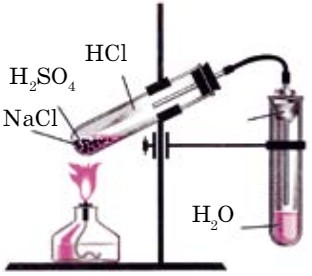
При добавлении концентрированного раствора серной кислоты к твердой поваренной соли протекает реакция обмена (рис. 65). Полученный хлороводород хорошо растворяется в воде, образуя соляную кислоту:
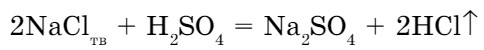
Общая схема реакции обмена:
соль + кислота = новая соль + + новая кислота
Реакции обмена протекают только при условии, если кислота, вступающая в реакцию, сильнее и устойчивее кислоты, выделившейся в результате реакции.
- При взаимодействии солей со щелочами образуются нерастворимые основания или соли:
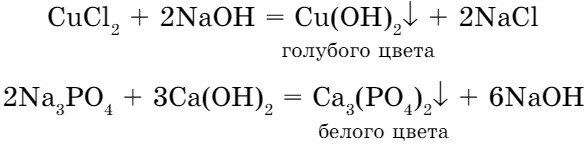
соль + основание (растворимое) = новая соль + новое основание
- Взаимодействие солей между собой.
К раствору хлорида бария добавим раствор сульфата натрия, при этом наблюдаем выделение белого осадка сульфата бария (рис. 66).
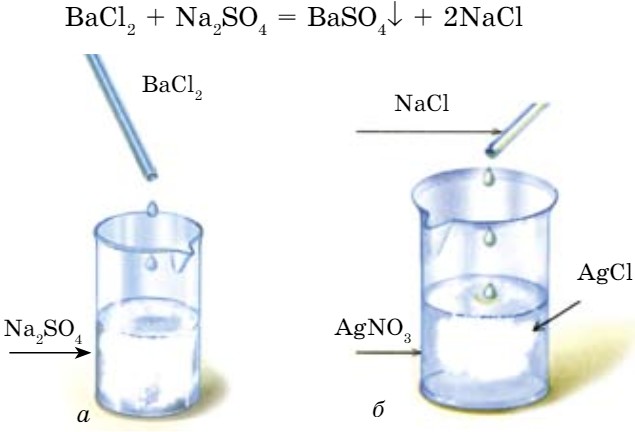
Такие реакции между солями протекают при соблюдении следующих правил:
- обе исходные соли должны быть растворимыми;
- одна из солей, образовавшихся в результате реакции, должна быть нерастворимой, т. е. выпасть в осадок (↓). При добавлении к раствору поваренной соли раствора нитрата серебра выпадает белый творожистый осадок (рис. 66, б).
NaCl + AgNO3 = NaNO3 + AgCl↓
Общая схема взаимодействия солей:
соль (1) + соль (2) = новая соль (3) + новая соль (4) ↓
- Некоторые соли при нагревании разлагаются:
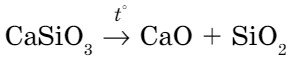
- Многие соли при взаимодействии с водой химически реагируют с ней, образуя вещества, называемые кристаллогидратами. При добавлении воды к белому (обезвоженному) сульфату меди образуется голубой раствор и выделяется тепло. Данные признаки свидетельствуют о протекании химической реакции (рис. 67). Вода в формуле кристаллогидратов называется кристаллизационной водой.
CuSO4 • 5H2O — медный купорос, пентагидрат сульфата меди (II)
FeSO4 • 7H2O — железный купорос, гептагидрат сульфата железа (II) Na2SO4 • 10H2O — глауберова соль, декагидрат сульфата натрия
Na2CO3 • 10H2O — кальцинированная сода, декагидрат карбоната натрия.

Это интересно!
Когда-то поваренная соль была особо ценным и малодоступным продуктом.
Легионерам Древнего Рима даже часть жалованья выплачивали солью. В Тибете в XIII в. в качестве монет служили лепешки из соли. А на празднествах в Древней Руси соль подавалась только самым знатным. Остальные уходили не солоно хлебавши.
А
1. Закончите уравнения возможных реакций:

- В каких из приведенных уравнений реакций формулы продуктов реакции написаны неправильно? Расставьте соответствующие коэффициенты. Исправьте формулы.
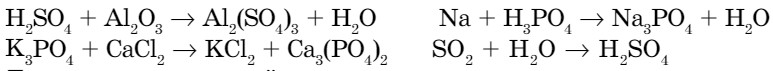
- Даны названия солей, которые часто применяются в медицине, сельском хозяйстве. Приведите их международные названия, напишите графические формулы.

- Возможно ли протекание реакции, если: а) в раствор нитрата свинца (II) ввести цинк; б) в раствор хлорида железа (II) ввести медь?
B
- В каких из приведенных уравнений реакций формулы написаны неверно? Формулы напишите правильно, уравняйте реакции.
AgNO3 + HCl → AgCl2 + HNO3
Cu + Hg(NO3)2 → Cu(NO3)2 + Hg
NaCO3 + BaCl2 → BaCO3 + NaCl
- Рассчитайте массу хлорида серебра (I), который образуется при взаимодействии 34 г нитрата серебра с хлоридом натрия.
Ответ: 28,7 г.
3. Закончите уравнения возможных реакций:
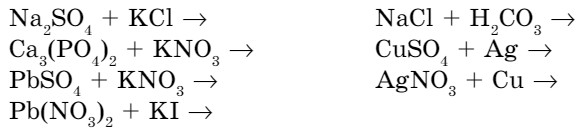
Рассчитайте массу сульфида железа (II), который прореагировал с соляной кислотой, если в результате реакции выделилось 89,6 л сероводорода.
Ответ: 352 г.
- Составьте формулу соли, если отношение масс элементов т (Са) : т (Н) : т (Р) : : т (О) = 20 : 2 : 31 : 64. Назовите эту соль.
- Рассчитайте молярную концентрацию сульфата натрия, если в 500 мл раствора содержится 0,2 моль Na2SO4 • 10Н2О.
Ответ: 0,4 моль/л.
- Расположите соли по возрастанию в них массовой доли серы:
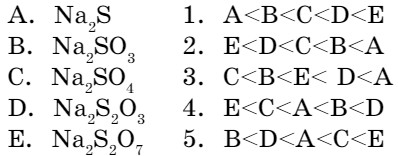
Лабораторный опыт №9
Свойства и получение солей
| Реактивы | Химическая посуда, оборудование |
| CuSO4 (р-р) — сульфат меди (II), CaCO3 - карбонат кальция (мрамор или мел), HCl (р-р) - соляная кислота, NaOH (р-р) — гидроксид натрия, Са(ОН)2 - известковая вода, BaCl2 (р-р) — хлорид бария, Na2SO4 (р-р) — сульфат натрия | Пробирки, пипетка, пробирка с газоотводной трубкой, штатив |
Опыт 1. Взаимодействие солей с щелочью. В пробирку налейте немного раствора сульфата меди (II), затем добавьте по каплям раствор щелочи до образования осадка. Какого цвета осадок? Напишите уравнение реакции.
Опыт 2. Взаимодействие солей. В пробирку налейте немного раствора хлорида бария, затем добавьте раствор сульфата натрия до появления осадка.
Опыт 3. Взаимодействие соли с кислотой и кислотного оксида с щелочью. Поместите в пробирку несколько мелких кусочков мрамора или мела и прилейте к нему раствор соляной кислоты. Выделившийся газ пропустите через известковую воду. Что наблюдается?
Вопросы и задания.
- Напишите уравнения химических реакций.
- Какие новые соли получены?
- Вспомните: какие опыты проделаны до этого по получению солей?
ДЕЛАЕМ ВЫВОДЫ
- Соли - сложные вещества, состоящие из атомов металлов и кислотных остатков.
- Соли делятся по составу на средние, кислые и основные.
- Соли вступают во взаимодействие с металлами, кислотами, солями и щелочами.
- Некоторые соли разлагаются при нагревании.
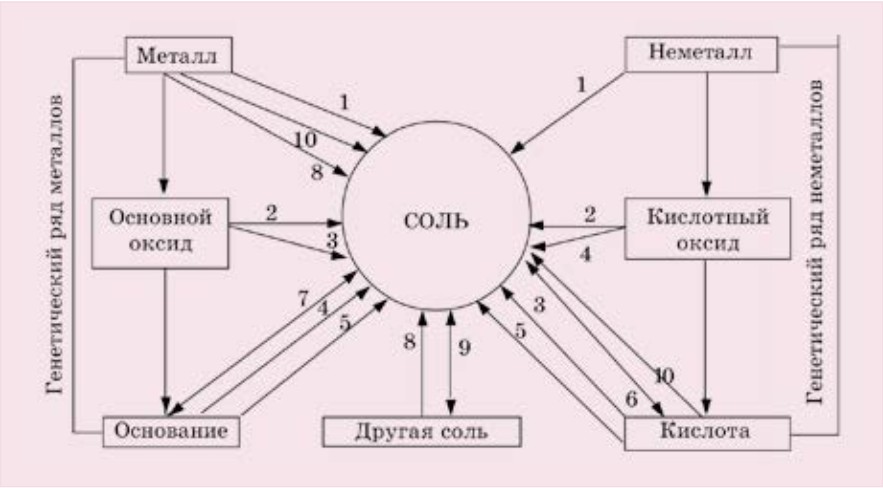
§50. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Вы уже познакомились со всеми простыми (металлы и неметаллы) и сложными (оксиды, кислоты, основания и соли) веществами и знаете, что из веществ одного класса можно получить вещества другого класса. Взаимосвязь между классами соединений называется генетической (от греческого генезис - происхождение) связью.
При составлении уравнений реакции по способам получения того или иного вещества необходимо учесть химические свойства атомов элементов, а также их соединений. Для этого составляются два генетических ряда:
металл → основной оксид → основание → соль;
неметалл → кислотный оксид → кислота → соль.
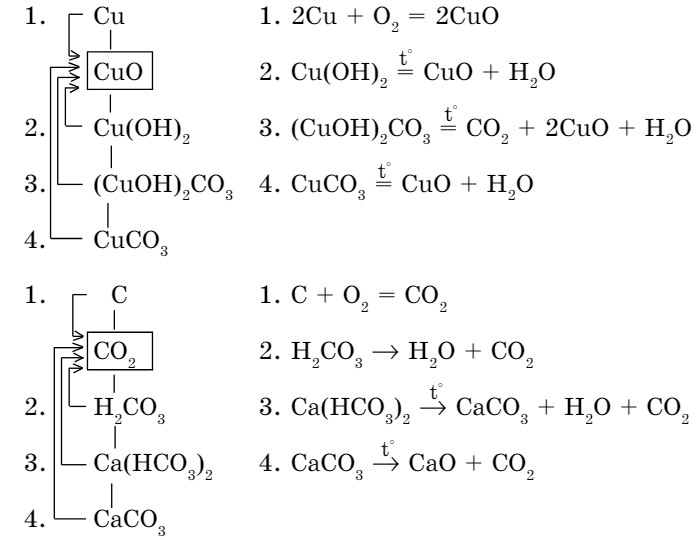
А при изучении химических свойств веществ используем оба ряда одновременно.
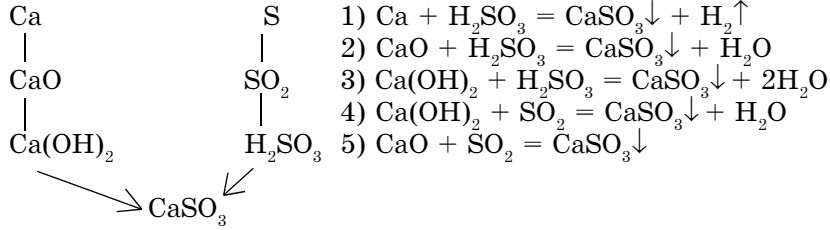
Рассмотрим генетическую связь между классами неорганических соединений на примере получения солей (схема 8).
Схема 8. Генетическая связь между классами неорганических соединений
- При непосредственном взаимодействии некоторых металлов с неметаллами (метод синтеза) образуются соли:
Fe + S = FeS
- Взаимодействием кислотных и основных оксидов между собой также можно получить соль:
CaO + CO2= CaCO3 белый порошок
- В результате взаимодействия основных оксидов с кислотами образуются соль и вода:
MgO + H2SO4 = MgSO4 + H2O
- К такому же результату приводит взаимодействие кислотных оксидов с основаниями:
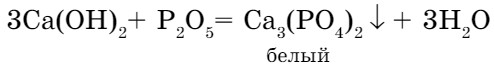
- Кислоты и основания взаимодействуют с образованием соли и воды: NаОН + НМО3 = NаNО3+ Н2О
- Соли с кислотами взаимодействуют с образованием новой соли и новой кислоты; новая соль выпадает в осадок или новая кислота распадается:
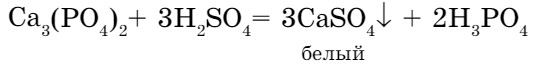
- Соли с основаниями взаимодействуют с образованием новой соли и нового основания. В результате этой реакции может выпасть в осадок либо основание, либо соль.
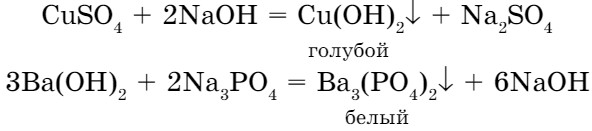
- При взаимодействии более активного металла с раствором соли выделяются металл и соль:
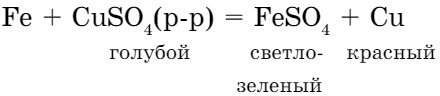
- Взаимодействие двух солей между собой дает две новые соли, одна из которых выпадает в осадок:
3ВаСl2+ 2Nа3РО4 = Ва3(РО4)2↓ + 6NаСl
- Металлы взаимодействуют с кислотами с образованием соли и водорода в зависимости от активности металла:
Мg + 2НСl = МgСl2 + Н2↑
А
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Fе → Fе2О3 → FеСl3 → Fе(ОН)3 → Fе2(SО4)3
- Назовите следующие соли:
Nа2S, NаНSО3, Сu(ОН)NО3, Са(Н2РО4)2
- Определите валентность кислотообразующего элемента в следующих солях: Nа2S, NаНS, Nа2SO4, Nа2SO3.
- Какая сода используется при приготовлении пищи: Na2CO3, NaHCO3?
В
- Напишите графические формулы следующих солей: сульфида, сульфита, гидросульфита и сульфата калия.
- С какими из приведенных веществ взаимодействует ZnO? Напишите уравнения реакций:
NaOH, CuSO4, H2SO4, CO2, Cu.
- С какими из приведенных веществ не взаимодействует: H2SO4 + (NaOH, Ca3(PO4)2, Mg, P2O5, CaO, HClO3);
б) KOH + (Na2CO3, PbI2, CaO, H3PO4, Pb(NO3)2)?
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P → P2O5 → H3PO4 → Na3PO4
CuO → CuCl2 → Cu(OH)2 → CuSO4
CaO → Ca(OH)2 → CaCl2 → CaSO4
С
- Рассчитайте массу фосфата кальция, который образуется из 300 г 35%-ного раствора фосфата калия.
Ответ: 76,77 г.
- Напишите уравнения реакций, с помощью которых можно получить два простых и пять сложных веществ, используя следующие вещества: Na, O2, P, H2O.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие генетические связи:
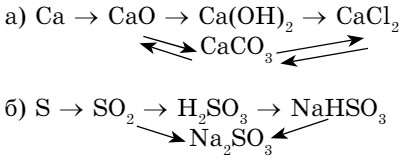
ДЕЛАЕМ ВЫВОДЫ
- Известны четыре основных класса неорганических соединений: оксиды, кислоты, основания, соли.
- Металлам соответствуют основные, а неметаллам - кислотные оксиды. Оксиды некоторых металлов являются амфотерными.
- Основным оксидам соответствуют основания, кислотным - кислоты, а амфотерным - амфотерные гидроксиды.
- Соли по составу подразделяются на кислые, средние и основные.
- Ряд, который показывает генетическую связь между классами соединений, называется генетическим рядом:
металл — основной оксид - основание — соль;
неметалл — кислотный оксид - кислота — соль.
- При написании уравнений взаимодействия воды, кислот и солей с металлами необходимо обратиться к ряду активности металлов.
- Для того чтобы прогнозировать, идет ли реакция между солями, необходимо использовать таблицу растворимости соединений.
