Химия для 8 класса — Усманова М.

| Название: | Химия для 8 класса |
| Автор: | Усманова М., Сакарьянова К., Сахариева Б. |
| Жанр: | Школьный учебник по Химии |
| Издательство: | Атамура |
| Год: | 2018 |
| ISBN: | 978-601-331-166-1 |
| Язык книги: | Русский |
Страница - 26
Глава XII. УГЛЕРОД И ЕГО СОЕДИНЕНИЯ
§51. ОБЩАЯ ХАРАКТЕРИСТИКА УГЛЕРОДА
Охарактеризуйте углерод по его месту в Периодической системе. Назовите соединения углерода и валентность углерода в этих соединениях.
Углерод в виде угля, копоти, сажи известен человечеству с незапамятных времен. Элементарная природа углерода была установлена А. Лавуазье в конце 1780-х годов. Свое название элемент получил в 1824 г., в переводе с латинского оно означает «уголь».
Положение в периодической системе. Углерод — элемент 2-го периода главной подгруппы IV группы (IVA), атомный номер 6, относительная атомная масса 12, в ядре атома содержится 6 протонов и 6 нейтронов (Ar=12), общее число электронов также 6.
Строение атома. Электронная конфигурация атома углерода: 1s2 2s2 2p2. Углерод — неметалл, р-элемент.
Валентные электроны (II, IV) размещены по орбиталям:
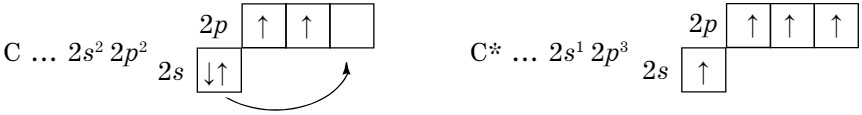
При возбуждении один электрон переходит с 2s- подуровня на 2р-подуровень. Поэтому в основном состоянии атом углерода двухвалентен (CO), а в возбужденном состоянии - четырехвалентен (СН4, СО2).
Нахождение в природе. Углерод входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, графита и карбина (аллотропные видоизменения, рис. 69). Природные соединения углерода - доломит СаСО3 • МgСО3, мрамор СаСО3, магнезит МgСО3. Нефть, каменный уголь и природный газ содержат углерод в связанном состоянии.
В свободном виде углерод не токсичен, а вот многие его соединения обладают значительной токсичностью.
Аллотропные видоизменения углерода характеризуются различным строением кристаллических решеток. Этим и объясняется резкое различие их физических свойств.
Физические свойства. Алмаз - самое твердое природное соединение на Земле. Это прозрачное, бесцветное, кристаллическое вещество, имеет тетраэдрическое строение, не электропроводен.
Графит - мягкий, непрозрачный, серого цвета, маслянистый и блестящий (рис. 68). Графит при температуре 2000оС и низком давлении превращается в карбин.
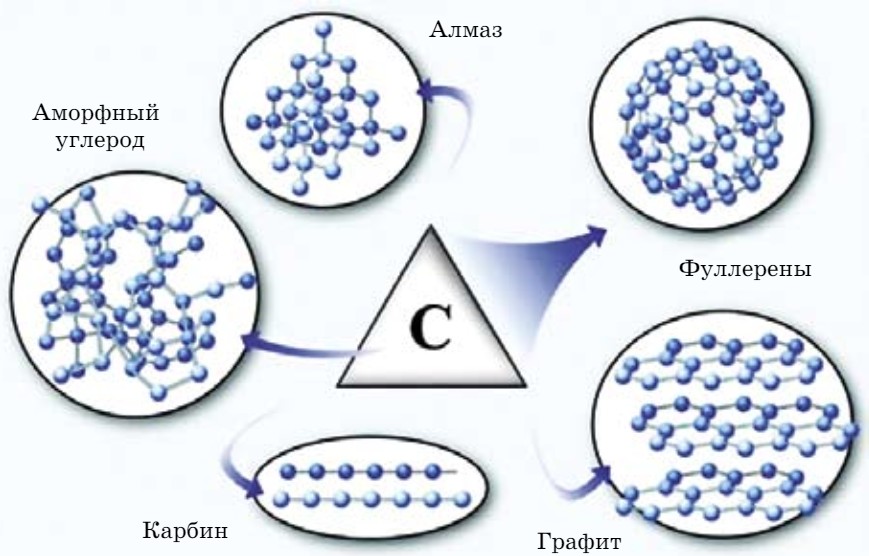
В последние годы открыли еще одну форму - фуллерен. У него структура, как у футбольного мяча.
К этим разновидностям можно прибавить аморфный углерод, простейшим представителем которого является древесный уголь. При сухой перегонке древесины образуется древесный уголь, у которого сильно выражена способность к адсорбции (поглощение на поверхности) газов, паров и растворенных веществ.
Получение. Сажа - аморфный углерод, продукт неполного сгорания углеводорода. Кокс - твердое искусственное топливо, продукт термической обработки каменного угля.
Запомни! Площадь поверхности активированного угля массой 1 г составляет 800 м2, поэтому он обладает повышенной адсорбционной способностью. Адсорбент - это вещество, способное поглощать на своей поверхности газы и жидкости. Таблетки активированного угля применяют для подготовки желудочно-кишечного тракта к рентгеновскому обследованию и УЗИ; для очистки спирта. Активированный уголь не поглощает угарный газ (СО).
Аллотропные видоизменения углерода.
А
- Какие аллотропные видоизменения углерода вы знаете?
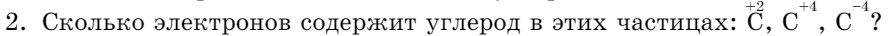
- Назовите природные соединения углерода.
В
- В каком карбонате: МgСО3, СаСО3 содержание углерода больше?
- Напишите графические формулы следующих соединений: СНСl3, СН2Сl2, ССl4, СН3Сl
С
1. Приведите в соответствие названия:

§52. ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод может вступать в реакцию со многими простыми и сложными веществами (схема 9).
Схема 9. Взаимодействие углерода с простыми веществами
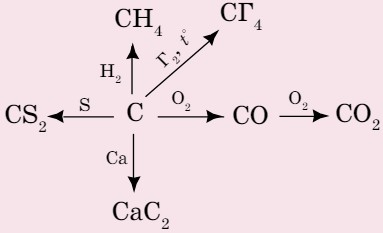
Далее приводятся некоторые уравнения реакций с простыми веществами:
1) a) при неполном сгорании углерода:
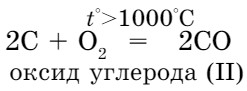


Применение. Алмаз используют для резки стекла, изготовления наконечников буровых установок. Из ограненного алмаза делают великолепные украшения (бриллианты).
Графит применяют для изготовления электродов, а также грифелей карандашей. Кокс (С) получают при сухой перегонке (нагревание без лоступа воздуха). Используется в производстве металлов как восстановитель. Адсорбционная способность активированного угля находит применение в медицине, а также в противогазах (рис. 69).

Фуллерены - это наночастицы, имеющие очень ценные особенности.
Каждая молекула содержит 60 атомов углерода, упорядоченных в виде пяти и шестиугольников и позволяет изготавливать кристаллы, которые применяются в электронике, в компьютерах.
- Вещество, занимающее второе место по твердости после алмаза.
- Аллотропное видоизменение углерода, которым пользуется каждый ученик.
- Самое твердое природное вещество.
- Углерод является хорошим поглотителем газов.
- Аллотропная модификация углерода, где его атомы расположены линейно.
- Устройство для защиты, где адсорбентом является активированный уголь.
- Соединения углерода с металлами.
Ключевое слово по вертикали - элемент, название которого в переводе с латинского означает «уголь».
Это интересно!
Самый большой алмаз «Куллинан» найден в 1905 г. в Южной Африке. Его масса 621 г (3106 каратов). Он был подарен английскому королю Эдуарду VII в день его рождения. При обработке алмаза были получены два крупных бриллианта.
Первый получил название «Звезда Африки», весит 580,2 карата. Сегодня это самый крупный в мире бриллиант. Он нашел место в верхушке королевского скипетра Великобритании. Второй, «Куллинан-П», весит 317,4 карата и украшает британскую корону (1 карат = 0,2 г.)
Адсорбция, углерод как адсорбент.
А
1. Рассчитать количество углерода, которое вступит во взаимодействие с 32 г оксида железа (III).
Ответ: 0,6 моль.
B
- Напишите уравнения реакций по данной схеме:
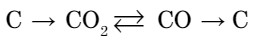
- Какой объем водяного газа образуется при пропускании водяных паров над углем в количестве 3 моль (считать, что уголь состоит из чистого углерода).
Ответ: 134,4 л.
С
- Какая масса гидроксида кальция необходима для поглощения газа, образовавшегося при сжигании 210 г угля (если считать, что уголь состоит из чистого углерода)?
Ответ: 1295 г.
- Какой объем воздуха (н. у.) используется для сжигания водяного газа (см. с. 190), полученного из угля массой 1 кг?
Ответ: 9,33 м3.
Это интересно!
В 2010 г. российские ученые К. Новоселов и А. Гейм получили Нобелевскую премию за исследование свойств графена.
Графен - монослой графита, в котором атомы углерода расположены, как в пчелиных сотах.
В будущем графен:
заменит кремний в микросхемах. Чипы из графена легче, устойчивее, употребляют мало энергии и в меньшем объеме рассеивают свет;
будет использоваться в космосе.
Практическая работа №6
Физические и химические свойства углерода
Цель: Знать условия образования диоксида и монооксида углерода при сжигании углерода.
| Реактивы | Оборудование, посуда |
| древесный активированный уголь;оксид меди (II);известковая вода, фуксин - красный | металлический штатив, пробирки, согнутый под прямым углом лист бумаги, спиртовки, спички, фильтровальная бумага, воронка, газоотводная трубка под прямым углом |
Ход работы
Опыт 1. Изучение древесного угля
- В коническую колбу налейте водный раствор какой-нибудь краски.
- Всыпьте в раствор 0,3—0,5 г мелко истолченного древесного угля, взболтайте содержимое в течение 2—3 минут.
- Отфильтруйте, наблюдайте исчезновение окраски.
Опыт 2. Восстановительные свойства угля.
- Примерно одинаковые по массе порции оксида меди (II) и измельченного древесного угля перемешать на листе бумаги.
- Смесь пересыпьте в сухую пробирку, укрепите горизонтально в штативе.
- Закройте пробирку пробкой с газоотводной трубкой, изогнутой под прямым углом.
- Конец трубки опустите в раствор известковой воды.
- Пробирку сильно нагрейте до прекращения выделения газа.
- Дайте пробирке остыть, отметьте цвет содержимого.
Вопросы и задания
- Как изменился цвет раствора красителя? Дайте объяснения.
- Напишите уравнения реакций опыта №2.
- Каким химическим свойством обладает углерод?
