Химия для 11 класса — Оспанова М.К.

| Название: | Химия для 11 класса |
| Автор: | Оспанова М.К., Аухадиева К.С., Белоусова Т.Г. |
| Жанр: | Школьный учебник по химии |
| Издательство: | Мектеп |
| Год: | 2019 |
| ISBN: | |
| Язык книги: | Русский |
| Скачать: |
Страница - 2
§3. ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА И ЕГО ГОМОЛОГОВ
Сегодня на уроке:
- изучим свойства аренов и их применение.
Ключевые понятия
- арены
- физические свойства
- химические свойства
- применение
Физические свойства. Бензол и его гомологи обычно жидкие вещества, имеющие своеобразный запах, нерастворимые в воде, но хорошо растворимые во многих органических соединениях. Огнеопасны. Температура кипения ароматических углеводородов закономерно повышается с увеличением их относительных молекулярных масс (табл. 2).
В больших дозах бензол и толуол вызывают тошноту и головокружение, а в некоторых тяжелых случаях отравление может повлечь смертельный исход. Пары бензола и толуола могут проникать через неповрежденную кожу. Хроническое отравление бензолом и толуолом может стать причиной лейкемии и анемии.
Физические свойства ароматических углеводородов


Химические свойства. Бензол и его гомологи могут вступать в реакции замещения, присоединения и окисления. Все арены, кроме бензола, окисляются сильными окислителями. Рассмотрим основные химические реакции бензола и его гомологов.
1. Реакции присоединения. Эти реакции не характерны для ароматических углеводородов, так как бензольное кольцо и л-электронная система очень прочны, поэтому такие реакции происходят в присутствии катализатора, при нагревании или УФ-облучении.
Гидрирование. В присутствии Ni-, Pt-, Pd-катализаторов, при высоком давлении и при нагревании бензол присоединяет водород, в результате реакции образуется циклогексан:
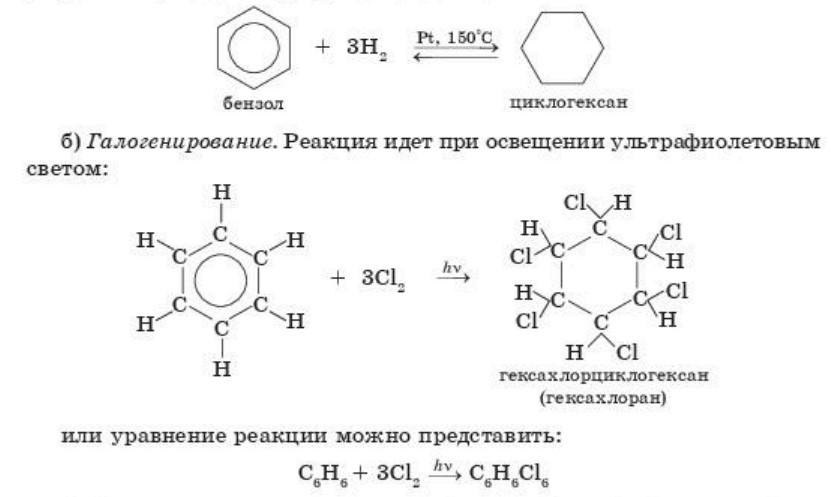
Гексахлоран применяется в сельском хозяйстве как ядохимикат.
Галогеноводороды и вода к ароматическим углеводородам не присоединяются.
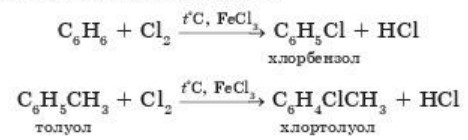
2. Реакции замещения. Бензол и его гомологи вступают в реакции замещения легче, чем алканы. Они могут реагировать с галогенами, азотной кислотой и другими веществами. Рассмотрим некоторые из этих реакций.
а) Галогенирование. Реакции замещения аренов галогенами протекают в присутствии солей железа (III):
б) Нитрование. Реакция нитрования бензола и его гомологов идет в присутствии нитрующей смеси (смесь концентрированных серной и азотной кислот):
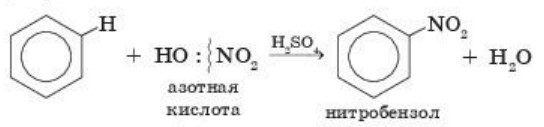
В результате образуется нитробензол.
Гомологи бензола, вследствие взаимного влияния атомов в бензольном кольце, реагируют с азотной кислотой иначе:
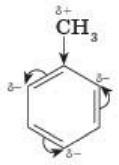
Замещение происходит в трех положениях бензольного кольца: 2, 4, 6 (орто-, пара-положениях):
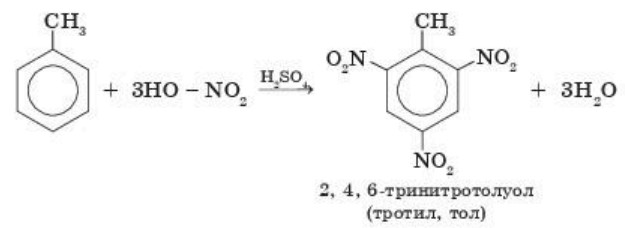
Вследствие такой реакции образуется сильно взрывчатое вещество тротил, который применяют для взрывных работ (при прокладке тун нелей, шахт, метро и т. д.).
3. Реакции окисления. Бензол очень устойчив к действию окислителей, и обычные окислители на бензол не действуют. А гомологи бензола, например, толуол, легко обесцвечивают раствор перманганата калия, образуя бензойную кислоту (рис. 4):
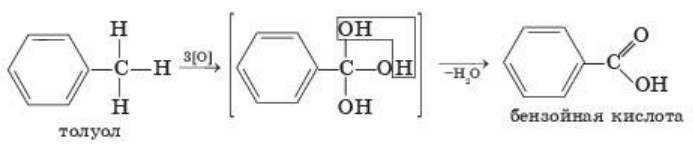
Бензойная кислота (консервант Е-210) — природный консервант, содержащийся в клюкве и бруснике. Используется при изготовлении напитков, плодово-ягодной продукции, рыбопродуктов.

Среди ароматических углеводородов есть разновидности таких веществ, в которых есть радикалы, содержащие кратные связи. Таким веществом является, например, винилбензол (полистирол) (рис. 5):
Этот углеводород обладает и свойствами гомологов бензола, но проявляет и свойства непредельных углеводородов. Винилбензол обесцвечивает бромную воду, реагирует с галогеноводородами и т. д. Но самым важным свойством стирола является реакция полимеризации, в результате которой получается полимер-полистирол:

Из полистирола изготавливают разнообразную продукцию.
Применение. Бензол является исходным веществом для синтеза огромного числа органических соединений, играющих важную роль в


нашей жизни: медикаментов, красителей, средств защиты растений, пластмасс и синтетических волокон и др. (рис. 6). Он является также хорошим растворителем для многих органических веществ.
Бензол и его гомологи могут вступать в реакции присоединения, замещения и окисления. Б присутствии катализаторов, при высоком давлении и при нагревании бензол присоединяет водород. Бензол и его гомологи легче вступают в реакции замещения, чем алканы. Они могут реагировать с галогенами, азотной кислотой и другими веществами. Все арены, кроме бензола, окисляются сильными окислителями.
- Какие физические свойства характерны для аренов?
- В какие реакции вступают бензол и его гомологи?
- Напишите уравнения бромирования бензола на свету и при участии катализатора. Назовите продукты реакций.

ЛАБОРАТОРНАЯ РАБОТА № 1
Составление модели молекулы бензола
Лабораторное оборудование: набор для построения шаростержневых моделей молекул органических соединений.
Ход работы: Напишите структурную формулу бензола. Возьмите из набора 6 шариков черного цвета, которые будут символизировать атомы углерода, необходимое число шариков белого цвета, которые будут символизировать атомы водорода. Химическая связь изображается металлическими стержнями.
При помощи стержней атомы углерода и водорода соедините между собой в цикл согласно структурной формуле бензола.
Раздел 1. Соединения ароматического ряда
Молекула бензола, C6H6 имеет циклическое строение, гексагональное строение, ароматическую связь.
Арены имеют общую формулу СnН2n-6, молекулы данных веществ очень прочны за счет нелокализованной л-связи, прочного бензольного кольца.
Механизм реакций замещения для аренов электрофильный, атомы водорода в ходе такой реакции замещаются на атомы галогенов, нитрогруппу и т.п.
Арены проявляют свойства и предельных {реакции замещения) и непредельных (реакции присоединения) углеводородов. Бензол не вступает в реакции характерное для непредельных УВ, не обесцвечивает бромную воду. В реакции с сильными окислителями гомологи бензола, образуют бензойную кислоту и другие оксокислоты.
Производное бензола — винилбензол (стирол). Химические свойства стирола определяются наличием бензольного ядра и двойной связи в боковой цепи. Стирол легко окисляется, полимеризуется. Важным его производным является полимер поливинилбензол (полистирол).
Глава II. ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
§4. "НОМЕНКЛАТУРА И ИЗОМЕРИЯ ЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ". НОМЕНКЛАТУРА ИЮПАК ДЛЯ АРОМАТИЧЕСКИХ И ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Сегодня на уроке:
Изучим ароматические и гетероциклические соединения.
Ключевые понятия
- циклические соединения;
- гетероциклы:
- номенклатура изомерия
Классификация. Первым классификационным критерием служит деление органических соединений на группы с учетом строения углеродного скелета (2-схема).
Ациклические соединения — это соединения с незамкнутой цепью атомов углерода. Алифатические (от греч. aleiphar — жир) углеводороды — простейшие представители ациклических соединений — содержат только атомы углерода и водорода и могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины). Циклические соединения — это соединения с замкнутой
Классификация органически к соединении по строению углеродного скелета

целью атомов. В зависимости от природы атомов, составляющих цикл, различают карбоциклические и гетероциклические соединения.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на ароматические и алициклические (циклические неароматические). Число атомов углерода в циклах может быть различным. Известны большие циклы (макроциклы), состоящие из 30 атомов углерода и более.
Для изображения циклических структур удобны скелетные формулы, в которых опускают символы атомов углерода и водорода, но символы остальных элементов (N, О, S и др.) указывают. В таких формулах каждый угол многоугольника означает атом углерода с необходимым числом атомов водорода (с учетом четырехвалентности атома углерода).
Циклические соединения также классифицируют на карбоциклические и гетероциклические (схема 3).
Классификация циклических соединений
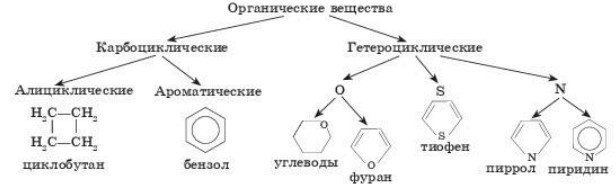
Циклические соединения. Для наименования циклических соединений широко применяются тривиальные названия, и многие из них приняты как основные в систематических номенклатурах. Наиболее полная номенклатура циклических соединений разработана в правилах IUPAC. Ниже приведены лишь некоторые сведения, главным образом о старых способах наименования циклических систем, которые встречаются до сих пор.
Алициклические соединения. В основу названий алициклических соединений положены названия насыщенных циклических углеводородов Сn Н2n, общее систематическое название которых — циклоалканы. Их называют также циклопарафинами; по старой номенклатуре эти углеводороды называли полиметиленами; триметилен, тетраметилен, пентаметилен, гексаметилен и т. д. — по числу метиленовых групп (-CH2-) в кольце:
Алициклические углеводороды циклоалканы
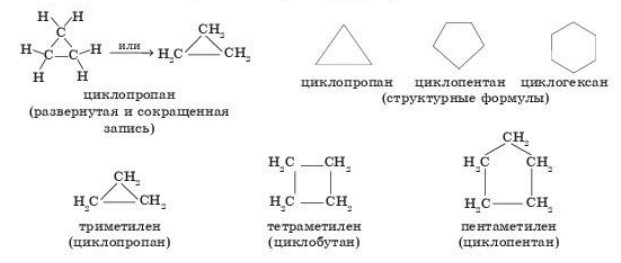
Непредельные алициклические углеводороды с двойной связью (цикло алкены) называют также циклоолефинами.
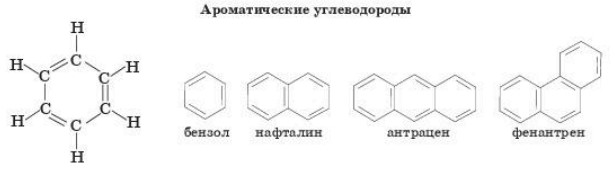
Ароматические соединения. Соединения ряда бензола.
Простейший ароматический углеводород C6H6 имеет тривиальное название бензол. Все остальные углеводороды этого ряда могут быть названы как замещенные производные бензола, или имеют свои тривиальные названия. При этом по традиции, установившейся в русском языке, почти все тривиальные названия гомологов бензола также имеют окончание -ол.
Например:
С6Н5СН3 — метилбензол иди толуол;
C6H4(CH3)2— диметилбензол или ксилол;
C6H5CH(CH3)2 — изопропилбензол или кумол;
Как исключение С6H3(СН3)2 — 1,3,5-триметил бензол имеет название мезитилсн.
По правилам IUPAC все названия ароматических углеводородов характеризуются окончанием -ен. Соответственно: бензен, толуен, ксилен, цимен, старей и т. д. Но эти названия практически не применяются.
Родоначальником ароматических углеводородов (аренов) является бензол. Нафталин, антрацен и фенантрен относятся к полициклическим аренам. Они содержат конденсированные бензольные кольца.
По строению углеродной цели органические соединения делятся на две большие группы: ациклические {соединения с открытой целью) и циклические — соединения с замкнутой целью углеродных атомов.
Циклические соединения делятся на карб о циклические и гетероциклические. Название циклических соединений производят по правилам международной номенклатуры IUPAC.

