Химия для 11 класса — Оспанова М.К.

| Название: | Химия для 11 класса |
| Автор: | Оспанова М.К., Аухадиева К.С., Белоусова Т.Г. |
| Жанр: | Школьный учебник по химии |
| Издательство: | Мектеп |
| Год: | 2019 |
| ISBN: | |
| Язык книги: | Русский |
| Скачать: |
Страница - 3
§5. КЛАССИФИКАЦИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Сегодня на уроке:
Изучим состав и строение гетероциклических соединений.
Ключевые понятия
- гетероциклы;
- гетероатомы;
- классификация;
- номенклатура.
Гетероциклические соединения один из самых многочисленных классов органических соединений, они содержат в цикле, кроме атомов углерода, один иди несколько атомов других элементов — гетероатомов (от греч. heteros — другой, иной): азот, кислород, серу и др.

Гетероциклы принято классифицировать по содержанию гетероатома (азото-, сера-, кислородосодержащие). Кроме этого, гетероциклы принято делить по количеству циклов (схема 5).
Примеры гетероциклов (схема 5)
Пятичленные гетероциклы с одним и двумя гетероатомами

Шестичленные гетероциклы с атомами азота

Конденсированные гетероциклы
Номенклатура гетероциклических соединений.
В настоящее время разработаны приставки для обозначения различных гетероатомов, в том числе, металлов. Они образуются от названий элементов оканчиваются на -а (по этой причине их иногда называют а-приставками). Например, азот, кислород и сера обозначаются приставками аза-, окса- и тиа- соответственно. Если в цикле присутствует два одинаковых гетероатома, то это отражается в названии при помощи приставок ди-, три-, тетра- и т. д.
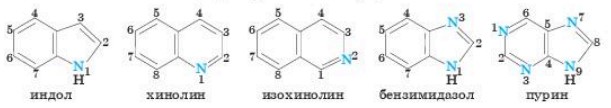
Для большой группы гетероциклических соединений допускают использование тривиальных названий, сложившихся исторически (например, индол), всего таких названий около 60. В остальных случаях: названия (их именуют систематическими) составляют по специальным правилам ИЮПАК, которые в этом случае своеобразны и отличаются от той системы, которая принята для большинства органических соединений иных классов. Из специально предложенных для этой цели корней и приставок формируют название, соблюдая оговоренный порядок. В его основе лежит корень, состоящий из двух слогов. Первый слог указывает на количество звеньев цикла, например, слог “ир” (две переставленные буквы из латинского корня “tri”) соответствует трехчленному циклу, слог “ет” (фрагмент латинского tetra) четырехзвенный цикл, слог “ок" (часть латинского octa) используют для восьмичленных циклов. Происхождение некоторых других слогов, обозначающих размер цикла, не всегда логически обосновано, например, для шестичленных циклов используют слог “ин”, взятый из названия распространенного гетероцикла "пиридин".
Второй слог указывает, является ли гетероцикл насыщенным слог “ан”, или ненасыщенным слог “ен” (аналогия с названиями углеводородов: этан этен). Перед корнем помещают приставку, обозначающую природу гетероатома: О -окса, S- тиа, N- аза. Поскольку корень часто начинается с гласной буквы, в приставке обычно опускают последнюю букву “а”. Трехчленный О-содержащий ненасыщенный цикл называют оксирен, а насыщенный-оксиран (схема 6). Если в гетероцикле несколько гетероатомов, то их положение указывают с помощью числовых индексов, пронумеровав предварительно атомы в цикле, а количество таких атомов обозначают приставками ди-, три- и т.д., например, 1,3,5-триавин. Если есть различные гетероатомы, их упоминают в следующем порядке: О > S > N.

Основа названия присваивается гетероциклу в зависимости от размера цикла. Для насыщенных и максимально ненасыщенных гетероциклов также применяют различные наборы основ. Также иногда применяются специальные основы для указания на частичную ненасыщенность гетероцикла. Например, насыщенные гетероциклы, не содержащие азота, получают основы:
- -иран (для трёхчленного цикла),
- -стан (для четырёхчленного цикла),
- -алан (для пятичленного цикла),
- -ан (для шестичленного цикля) и т. д.
Примером использования различных основ при построении названий гетероциклических соединений могут служить насыщенные кислород- содержащие гетероциклы.

Гетероциклы имеют самые различные области применения: тиофен -медицина (ихтиоловая мазь), фурфурол (хлебопечение). Многие из них образуются в нашем организме: индол образуется при гниении белков в кишечнике; триптофан входит в состав белков.
Существует ациклические и циклические органические соединения. Важнейшими представителями циклических веществ является бензол и его производные. Гетероциклические соединения могут различаться по соедержанию гетеро атомов (азота, серы, кислорода) и по количеству циклов (три-четыре-пяти-шести и др атомные). Существует тривиальная и систематическая номенклатура таких циклических соединений.
По строению углеродной цени органические соединения делятся на две большие группы: ациклические соединения с открытой цепью циклические — соединения с замкнутой цепью углеродных атомов.
Циклические соединения
Ациклическим соединениям относят: насыщенные и ненасыщенные углеводороды.
Циклические соединение делятся на карбоциклические и гетероциклические.
Карбоциклические соединения делятся на алициклические и ароматические.
В циклы гетероциклических соединений входят не только атомы углерода, но и другие элементы (азота, серы, кислорода).
Глава III. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
§ 6. СТРОЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
Сегодня на уроке:
изучим строение карбонильных соединений.
Ключевые понятия
• альдегиды
• кетены
• карбонильная группа
• строение
• изомерия
• номенклатура

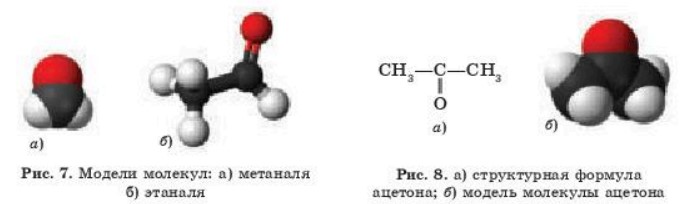
Модели молекул метаналя и этаналя представлены на рис 7.
В кетонах карбонильная группа связана с двумя одинаковыми или разными углеводородными радикалами. Простейший представитель кетонов — ацетон (рис. 8).
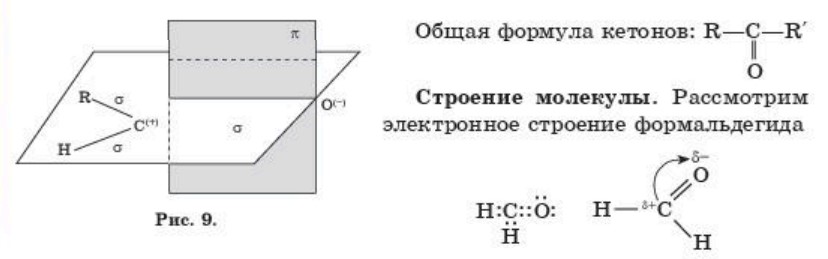
В молекуле формальдегида между атомами углерода и водорода существует о-связь, в между атомами углерода и кислорода — одна о-связь и одна л-связъ. Атом углерода находится в состоянии sp2- гибридизации. В связи с большей электроотрицательностью атома
кислорода по сравнению с атомом углерода, электронная плотность л-связи смещена от атома углерода к атому кислорода, в результате чего углерод приобретает частичный положительный заряд, кислород — частично отрицательный заряд (рис. 9). Полярность карбонильной группы оказывает существенное влияние на физические и химические свойства окcосоединений.
Изомерия и номенклатура. У альдегидов различают изомерию углеродного скелета и межклассовую изомерию с кетонами. Для кетонов характерна изомерия углеродного скелета и положения карбонильной группы.
По международной номенклатуре названия альдегидов образуются от названий соответствующих углеводородов с добавлением суффикса -алъ. Некоторые альдегиды имеют тривиальные названия, или названия, произведенные от соответствующих кислот. НСНО — метаналь (формальдегид, муравьиный альдегид), СН3 — СНО — этаналь (ацетальдегид, уксусный альдегид).
Для альдегидов разветвленной цепью перед названием указывают положения заместителей в углеродной цепи. Например,
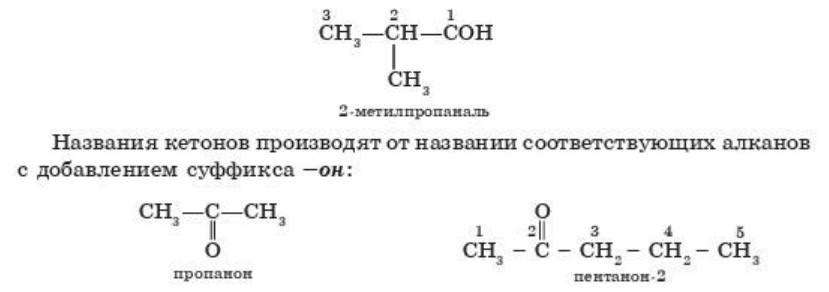
Нумерация цепи начинается с того конца, ближе к которому расположена карбонильная группа.

§7. ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Сегодня на уроке:
Изучим способы получения альдегидов и кетонов.
Ключевые понятия
- окисление
- Гидратация
- Кумольный способ
В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода, перманганат калия и другие вещества.
1. Окисление спиртов.
Проведем такой опыт. Накалим в пламени спиртовки спираль из медной проволоки и опустим ее в п iso бирку со спиртом. Мы заметим, что проволока, покрывающаяся при нагревании темным налетом оксида меди (II), в спирте вновь становится блестящей, одновременно обнаруживается запах альдегида:

В общем виде окисление спиртов можно показать так:

При окислении первичных спиртов образуются альдегиды. При окислении вторичных спиртов образуются кетоны.
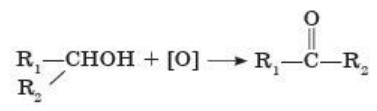
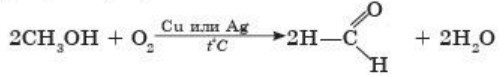
Для простоты окислитель обозначают в виде атома кислорода. В промышленности основную массу формальдегида производят из метанола, пропуская его пары вместе с воздухом через реактор с раскаленной сеткой из меди или серебра:
2. Гидратация алкинов.
Гидратация алкинов-присоединение воды к алкинам {реакция Кучерова).
Этаналь получают в промышленности преимущественно гидратацией ацетилена в присутствии солей ртути в качестве катализатора (реакция Кучерова).

Кетоны получают:
а) при гидратации гомологов ацетилена:

б) при окислении пропилена:
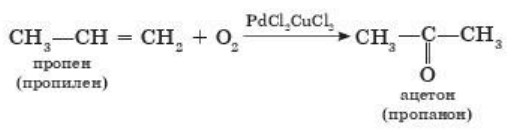
3. Окисление алкенов. Ацетальдегид можно получить из этилена окислением кислородом в присутствии медных, железных и палладиевых катализаторов. Для этого смесь этилена с воздухом пропускают через раствор солей меди, железа и палладия. Упрощенно процесс можно показать так:

Этот способ более перспективен, чем гидратация алкинов, при котором используются токсичные ртутные катализаторы.
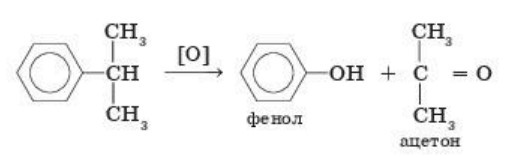
4. Кумольный способ получения ацетона
Альдегиды и кетоны относятся к карбонильным соединениям. Карбонильные соединения — это производные углеводородов, которые содержат карбонильную группу
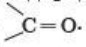
Альдегиды — это карбонильные соединения, в молекулах которых карбонильная группа связана с атомом водорода и углеводородным радикалом. В кетонах карбонильная группа связана с двумя одинаковыми или разными углеводородными радикалами. По международной номенклатуре названия альдегидов образуются от названий соответствующих углеводородов с добавлением суффикса -аль. Названия кетонов производят от названий соответствующих алканов с добавлением суффикса -он.

